Саркопения: характеристика, механизмы и функциональное значение
Саркопения характеризуется постепенным снижением анаболических процессов и повышением катаболических, наряду с понижением способности к регенерации мышц. Происходит падение показателей мышечной силы и мощности быстрее, чем изменяются размеры мышцы: чем старше человек, тем слабее мышцы.
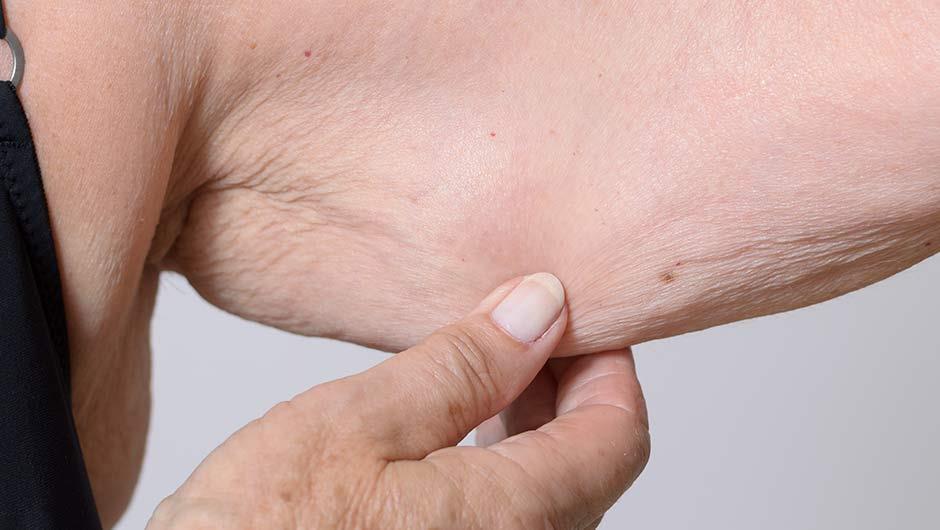
Narici, V.M. Sarcopenia: characteristics, mechanisms and functional significance / M. V. Narici, N. Maffulli // British Medical Bulletin 2010; 95: 139–159
Нарици В.М., Маффулли Н.
Саркопения: характеристика, механизмы и функциональное значение
Аннотация
Саркопения характеризуется постепенным снижением анаболических процессов и повышением катаболических, наряду с понижением способности к регенерации мышц. Происходит падение показателей мышечной силы и мощности быстрее, чем изменяются размеры мышцы: чем старше человек, тем слабее мышцы. Саркопеническое ожирение среди пожилых людей способствует потере мышечной массы, повышает риск развития метаболического синдрома. Недавние исследования включают вопросы мышечно-скелетной адаптации при старении и ключевые статьи о механизмах атрофии мышц, а также включительно о функциональном влиянии на саркопеническое ожирение. На развитие саркопении влияют нейропатические, гормональные, иммунологические, диетологические и физические факторы активности. Атрофия быстрых мышечных волокон, уменьшение количества двигательных единиц и увеличение гибридных волокон, представляют собой типичные признаки старения. Уменьшение числа клеток-сателлитов приводит к понижению регенеративных способностей мышцы. Саркопеническое ожирение способствует дальнейшей атрофии мышц и увеличивает риск развития метаболического синдрома. Пропорция быстрых и медленных мышечных волокон остаётся прежней. У пожилых людей, миоядерный домен поддерживается на постоянном уровне. Показатели базального синтеза и распада белка претерпевают небольшие изменения в старости. Однако, наблюдается притупление анаболических реакций при питании, физических упражнениях и антипротеолитическом эффекте инсулина. Дальнейшее понимание механизмов саркопении требует отделения признаков старения отдельно от болезней. Также нуждаются в прояснении причины большей анаболической устойчивости к физическим упражнениям и питанию у пожилых женщин. Особенно перспективным представляется усиление регенерации мышц с помощью активации клеток-сателлитов молекулярными путями трансдукции.
Введение
Потеря плоти и энергии при старении, приковала внимание человечества с начала Греческой и Римской истории. Классические греки гнушались старения, так как оно представляло собой явление, а они очень ценили молодую энергию и старение рассматривали как хроническую, неизлечимую и прогрессирующую болезнь (Аристотель, 384 ВС). Однако, греческий врач Гален из Пергамена (теперь часть Турции), который в 37 лет переехал в Рим, рассматривал старение не как болезнь, но промежуточный этап между здоровьем и болезнью, и признал преимущества умеренных физических нагрузок и питания для здорового старения. Цицерон (44 ВС) также отклонил понятие старения, как необратимую болезнь и выступал против широко распространенного среди большинства членов общества мнения, что пожилые мужчины, потому что физически хилые, должны воздерживаться от любых действий, в том числе не требующих физической силы. В своем трактате «Cato Maior de senectute», Цицерон утверждает: «В старости человек лишен силы, поэтому от него ничего нельзя уже ожидать. По закону и по обычаю мужчины моего возраста освобождаются от тех государственных услуг, которые не могут быть оказаны без силы тела…нам не только не нужно делать то, что мы не можем выполнять, но нам не нужно делать даже то, что мы можем». Немного позже он утверждает: «Это наш долг…противостоять старости, компенсировать свои недостатки, бороться с ними, поскольку мы будем бороться с болезнью; нужно принять режим здоровья; практиковать умеренные упражнения; и принимать достаточно еды и напитков для восстановления нашей силы».
Эта обеспокоенность борьбы с физической немощностью в старости, сохраняя активную роль в жизни, действительно крайне актуальна, так как мы вступили в третье тысячелетие, с долей пожилых граждан, превышающих количество молодых людей.
Если проблема физической немощности в старости успешно решается, при этом добиваются эффективного поддержания мобильности и независимости до индивидуального предела хронологического возраста, то полное понимание этиологии и механизмов, отвечающих за атрофию мышц и слабость изучаются впервые.
Поэтому целью данной статьи является анализ механизмов, приводящих к потере мышечной массы в пожилом возрасте, анатомические изменения и их функциональные последствия.
САРКОПЕНИЯ – термин, предложенный Розенбергом в 1989 году (1) обозначает потерю мышечной массы, связанную со старением. Тем не менее, значение этого термина зачастую распространяется на связанную с возрастом потерю мышечной силы. Хотя мышечная слабость действительно является неизбежным следствием саркопении, эти два термина не должны быть использованы как синонимы, так как это будет означать прямую пропорциональность между ними. Однако, как будет обсуждаться позже в этой статье , это не так, так как скелетные мышцы становится слабее по своей природе в старости. Следовательно, термин саркопения будет однозначно использоваться для обозначения потери связанных с возрастом мышечной массы и его отношение к потере мышечной силы будет еще подробно обсуждаться.
Оценка саркопении
Наиболее часто (широко) используется оценка саркопении, предложенная Janssen et al. (2), которая основана на скелетном индексе массы мышц, полученных путем деления аппендикулярной массы скелетных мышц (ASM), оцененной посредством двухэнергетической рентгеновской абсорбциометрии (DEXA), на высоту тела в квадрате (ASM/ ht2). Согласно этой оценке, люди имеющие соотношение ASM/ ht2 между 21 и 22 стандартных отклонений (SD) от гендерной-специфики среднего значения молодых людей, классифицируются как имеющие I класс саркопении. Соответственное лица, имеющие соотношение ASM/ ht2 соотношение ниже 2 SD классифицируются как имеющие II класс саркопении.
Другая оценка саркопении использует проценты индекса скелетных мышц (SMI%, общая мышечная масса / массу тела 100) (3). Хотя использование этих показателей для классификации саркопении может иметь практическое значение для клинических целей, они не кажутся очень точными. Это потому, что саркопения не является однородным условием, так как она влияет на постуральные мышцы больше, чем на те, которые не относятся к постуральным. Расчет основанный на DEXA, как известно, снижает массу конечностей тела на 20% (4).
Эпидемиология саркопении
Эпидемиологические исследования показали, что со второй по восьмую декады жизни общая мышечная масса тела уменьшается на 18% у мужчин и на 27% у женщин (подсчитанная с использованием уравнений, отражающих специфику полов Janssen et al. (2) – рисунок 2) и в любом возрасте взрослой жизни, женщины имеют значительно меньшую мышечную массу, чем мужчины. Со второй по восьмую декаду это различие между двумя полами довольно постоянное, мышечная масса тела женщин на 64% меньше, чем у мужчин. Оказывается, как у мужчин, так и у женщин уменьшение мышечной массы тела становиться заметным (обнаруживается) после 45-летнего возраста. Однако, так как общая масса тела значительно увеличивается с 18 до 40 лет, в то время как скелетно-мышечная масса остается практически постоянной не удивительно, что начало уменьшения мышечной массы тела, выраженной как процентное соотношение от общей массы тела, является заметной только в третьей декаде.
Региональное распределение саркопении
Как у мужчин, так и у женщин потеря мышечной массы больше в нижних конечностях (около 15 %), чем в верхних конечностях (около 10%) (3), что может показаться противоречивым здравому смыслу, если рассматривать постоянное использование нижних конечностей для передвижения. Причины для этого различия в настоящее время не ясны, однако, доказано, что физическая активность значительно сокращается в пожилом возрасте даже у полностью независимых людей пожилого возраста (6), большая потеря мышечной массы в нижних конечностях может происходить из-за эффекта детренированности. Другая причина – это то, что это различие может возникнуть от большой потери двигательных единиц (ДЕ) в ногах, чем руках. Хотя нет абсолютных данных по подсчету (ДЕ) в верхних конечностях, напротив, данные для нижних конечностях доступны для непосредственной оценки количества (ДЕ), основанных на электрофизиологических методиках (соотношение между потенциалом действия мышц и потенциалом действия ДЕ, определяемое для определенной поверхности), предполагают большее уменьшение количества ДЕ в дистальных мышцах, чем в проксимальных. Рассматривая местные изменения мышечной массы, особенно в тех мышцах, которые важны для передвижения, таких как мышцы бедра можно видеть, что мужчины и женщины теряют около 24-27 % мышечной массы (или объема, так как мышца имеют плотность 1.056 г/см3) или 25% площади поперечного сечения мышцы (8) второй и седьмой декадой жизни. Однако, когда саркопения ускоряется неиспользованием, болезнью или анорексией, эта потеря мышечной массы может подвергнуть женщин большому риску оказаться ниже уровня критической мышечной массы необходимого для подвижности и самостоятельного существования. Также, вероятнее, из-за их большого периода долголетия, женщины более часто проводят последние годы жизни под присмотром медицинских учреждений, чем мужчины.
Внутримышечное накопление жира и саркоплазматическое ожирение
Несколько исследований, основанных на компьютерной томографии (9-11), МРТ (12) и УЗИ (13) показали, что саркопения, то есть потеря мышечной ткани, сопровождается инфильтрацией жира в соединительную ткань мышцы. Это состояние известно как миостеатозис (11) – просачивание жира в скелетные мышцы. В результате часть сократительной мышечной массы на самом деле меньше, чем измеренная площадь поперечного сечения простой мышцы и ведет к ошибкам в измерении или оценивании сократительной мышечной массы пожилых женщин и мужчин. В лучшем случае, если эта несокращающаяся ткань, не учитывается. У пожилых женщин и мужчин процент жира в среднем составляет 15% от площади поперечного сечения мышцы, это примерно в 2,5 раза больше чем у молодых испытуемых у которых оно равно 6% (11). Было показано, что накопление жира и соединительной ткани находится в обратной зависимости от уровня физической активности, удвоение уровня физической активности практически в два раза снижает количество внутримышечного жира и соединительной ткани (12). Просачивание жира в скелетные мышцы, вызывает особое беспокойство у пожилых, так как саркопения сочетается с ожирением. Это состояние известно как саркопеническое ожирение. Baugartner (14) определяет саркоплазматическое ожирение как, отношение анатомического поперечника скелетных мышц (ASM/ht2) к росту в квадрате менее чем 2 стандартных отклонения по отношению к молодой здоровой группе людей, и как процентное соотношение жира в организме больше, чем 27% у мужчин и 38% у женщин.Используя это определение, распространенность саркоплазматического ожирения повышается с 2% у мужчин и женщин в возрасте 60 – 69 лет, примерно до 10% в возрасте 80 лет и выше. Жировая инфильтрация скелетных мышц представляет собой не только нагрузку для передвижения из-за добавленной инертной массы, которую приходится переносить человеку, но также считается, что это помогает саркопении пройти этап инфильтрации макрофагами и опосредованного высвобождения воспалительных цитокинов (TNF-α, IL-6, IL-1) и адипокинов (липтина, адипонектина и резистина) из адипоцитов (15). Появляется всё больше доказательств того, что возникающее хроническое воспаление может быть механизмом возникновения резистентности к инсулину (16,17), и эти широко распространенные нарушения обычно описывают как метаболический синдром (18). Эпидемиологические данные показывают, что саркоплазматическое ожирение связано с ускоренным снижением функций организма человека и высоким уровнем риска заболеваемости и смертности (19). Поскольку потеря мышечной массы связана с саркопенией, которая способствует возникновению резистентности к инсулину, связь между саркоплазматическим ожирением и саркопенией вероятно, создает порочный круг, в результате которого теряется мышечная масса, подвижность, возрастает резистентность к инсулину и риск развития метаболического синдрома (20).
Размер, количество и композиция мышечных волокон (МВ) в мышце
Уменьшение мышечной массы, что приводит к саркопении, включает в себя, как уменьшение размера мышечных волокон (атрофия), так и их числа (гипоплазия). В этом отношении, саркопения показывает принципиальное отличие от атрофии, которая предполагает только уменьшение размера мышечного волокна, но не количества мышечных волокон. Есть явные свидетельства того, что с возрастом мышечные волокна типа II, становятся более подвержены атрофии, чем тип I (21-23).
В одном из самых ранних исследований по этой теме (Larsson 24,25) сообщил, что у пожилых лиц в возрасте 55-60 лет, соотношение мышечных волокон типа I и типа II были на 23% и 42% меньше, чем в группе 20-29 летних людей. В соответствии с этим, в еще более ранее докладе, (Lexell 24-26) обнаружили, что у мышечных волокон типа II площадь поперечного сечения 80-летнего испытуемого была на 26% меньше, чем к 20-летнего испытуемого, в то время, как не существует никакого различия в площади поперечного сечения мышечных волокон типа I . Совсем недавно, (Andersen, 27) обнаружил, что площадь поперечного сечения мышечных волокон типа II у 85-летних людей на 57% меньше, чем у 25-летних испытуемых, но встречаются случаи с мышечными волокнами типа I , что на 25% меньше в группе пожилых испытуемых. Учитывая подтипы, можно сказать, что мышечные волокна типа II подвержены большей атрофии.
Волокна типа II В типа (или типа IIХ) подвержены большей атрофии, чем мышечные волокна типа II А у пожилых мужчин (22%, против 13%) и у женщин (30% против 24%)(26,28). Однако Klitgaard (23) обнаружил, что уменьшаются оба типа мышечных волокон (27% для типа II А и 31% для типа ІІХ). В доказательство гипотезы, что атрофия мышечных волокон преимущественно затрагивает постуральные мышцы, Klitgaard et al.(28) не нашли существенных различий между мышечными волокнами типа I, типа IIА и типа II Х в двуглавой мышце плеча у молодых и пожилых людей.
Однако, за последние 20 лет стало ясно, что чистое различие между типами волокон у молодых становится «смазанным» в старости, поскольку по крайней мере ни одна треть волокон не относится ни к типу I, ни к типу II, так как они экспрессируют и MHC-I и MHC-II (27,29,30). Объяснение этому была дано D’Antona (30,31). Он считает, что причиной является увеличение гетерогенности изоформ композиции мышечного волокна в старости.
По мере старения, из-за невропатических процессов, приводящих к денервации ДЕ, происходит потеря быстрых ДЕ в состав которых входят мышечные волокна типов IIA и IIX (32,33). И это ожидаемо вызывает переход к более медленному типу мышечных волокон. Однако, на экспрессии MHC влияет уровень физической активности. В то время как отсутствие тренировки показывает сдвиг в сторону быстрых изоформ мышечных волокон, тренировка (независимо от того, на выносливость или силу), приводит к сдвигу в сторону более медленных мышечных волокон от МВ типа 2X до МВ типа 2A (34,35). Следовательно, в профиле распределения мышечных волокон, старение действительно, не совсем отражает взаимодействие между нейро-дегенеративными возрастными изменениями и уровнем физической активности, который значительно варьирует у людей.
Морфологические и электрофизиологические исследования свидетельствуют об уменьшении количества мышечных волокон с возрастом (22,25). Эти исследования показали, что число ДЕ оставалось практически неизменным вплоть до шестого десятилетия, но в возрасте от 60 до 80 лет оно снизилось на 50% (22).
Аналогично, с помощью электрофизиологических методов, Campbell (32) сообщил, что количество ДЕ было практически постоянным в возрасте до 60 лет, но затем уменьшалось на 3% в год. В возрасте 80 лет потеря ДЕ составила 60%. Хотя ранние исследования сравнивающие молодых и пожилых людей сообщали, об уменьшении волокон II типа с сопутствующим увеличением соотношения I/II типа волокон (24) в соответствии с замедлением мышечных сократительных свойств (36, 37), последние данные свидетельствуют о том, что это не так. В проведенных исследований аутопсии, используя весь срез мышц поперечного сечения, а не образцы биопсии, Lexell (22,25, 38) нашел пропорциональное уменьшение числа мышечных волокон типа I и II латеральной широкой мышцы бедра. Этот вывод также подтверждается одним из нескольких продолжительных исследований, проведенных у одних и тех же людей старшего возраста, в течение 12 лет (39). Никаких доказательств сохранения волокон I типа обнаружено не было, так как в возрасте 65 лет доля волокон I типа составляла 60%, тогда как в возрасте 77 лет она составляла 40%. Текущее представление состоит в том, что со старением имеется потеря обоих типов волокон, однако их динамика различна. Большая потеря волокон типа II происходит до 70, а после 80 лет уменьшается доля и мышечных волокон типа I, и достигается новое соотношение между двумя типами волокон у людей в возрасте 85 – 97 лет (27).
Клетки-сателлиты и мионуклеарный домен
Мышечные волокна, как известно – это большие многоядерные клетки. Каждое ядро мышечного волокна контролирует определенный объем саркоплазмы, который называется мионуклеарный домен. Было установлено, что изменение объема мышечного волокна происходит пропорциональным изменением количества ядер мышечного волокна, при этом объем мионуклеарного домена остается постоянным (40). Предыдущие исследования, в основном на грызунах, были основаны на стандартной гистологии поперечных разрезов мышц. При этом использовался световой микроскоп (с которым часто бывает трудно доказывать отличие ядер мышечного волокна от ядер клеток-сателлитов). Из этих исследований следовало, что при гипертрофии мышц увеличение количества ядер в мышечных волокнах происходит за счет деления клеток-сателлитов. В то же время при атрофии количество миоядер уменьшается за счет апоптоза (41). Однако, уменьшение количества миоядер при атрофии мышц было найдено только у грызунов, а не у людей, и на самом деле подвергается сомнению в недавних исследованиях у мышиных, так же, как и у человеческих мышц.
Используя покадровую визуализацию живой ткани отдельных волокон, в которых ядра были помечены зеленым флуоресцентным белком, было обнаружено отсутствие уменьшения числа миоядер у семейства мышиных в денервированной мышце, несмотря на 50% уменьшение объема волокна (41). Схожие наблюдения были проведены на денервированных подошвенных мышечных волокнах у мыши (42).
Скудные данные, полученные на человеке, свидетельствуют, что уменьшения числа миоядер в связи со старением не происходит. Действительно, у пожилых, ослабленных людей в возрасте от 70 до 83 лет, у которых клетки-сателлиты и ядра мышечных волокон визуализировали с помощью моноклональных антител и контрастирующего гематоксилина Майера Kadi et al. (43) наблюдалось, что несмотря на меньшее число (25%-37%) клеток-сателлитов, количество ядер не было ниже, как сообщалось о мышцах животных в возрасте, а на самом деле выше (12%-19%), чем у контрольной молодой группы. Увеличение количества ядер (через активацию клеток-сателлитов) при уменьшенном размере мышечного волокна, говорит о снижении эффективности миоядер в пожилом возрасте (43) и не подтверждает концепцию постоянства миоядерного домена в пожилом возрасте, так как на каждое ядро мышечного волокна будет приходиться меньшее количество саркоплазмы, что позволяет прогнозировать снижение объема мионуклеарного домена.
Изменения в строении мышц
Морфологические изменения в скелетных мышцах, связанные с саркопенией, проявляются не только в значительном уменьшении площади поперечного сечения и объема мышцы, но и в самом её строении. Строение мышцы характеризуется расположением мышечных волокон, что главным образом определяет механические свойства мышц: называемые «длина-сила» и «сила-скорость» (45). Сила мышцы зависит от количества саркомеров, расположенных параллельно, т.е от площади поперечного сечения, в то время как скорость укорочения мышцы зависит от числа саркомеров, расположенных последовательно и составляющих длину волокна. В последние 20 лет проводилось множество исследований строения скелетных мышц человека с использованием УЗИ. С помощью этого метода при изучении икроножной мышцы молодых и пожилых людей Narici и др. (46) впервые установили, что длина пучков мышечных волокон и углы их прикрепления к сухожилию (угол перистости) с возрастом уменьшаются. Уменьшение длины пучков происходит из-за утраты саркомеров, расположенных последовательно, и приводит к снижению скорости сокращения мышцы, в то время как уменьшение угла перистости выражается в потере саркомеров, расположенных параллельно, а следовательно, и изменении площади поперечного сечения и силы, генерируемой мышцей (47).
Фактические причины этих изменений в архитектуре мышц состоят в том, чтобы реконструировать скелетную мышцу, в которой возникает атрофия. Уменьшение угла перистости объясняется эволюционными явлениями, которые привели к появлению перистых мышц. Это связано с тем, что расположение мышечных волокон в перистой мышцы является ответом на требование упаковки как можно большей сократительной ткани вдоль сухожильных апоневрозов, чтобы генерировать больше силы. Ведь гипертрофия мышц приводит к увеличению угла перистости (48). При атрофии, так как теряется мышечная ткань, упаковка сократительной ткани вдоль апоневроза сухожилия уменьшается. В конце концов, это удаление параллельно расположенных саркомеров (что приводит к уменьшению угла перистости поперечного сечения мышц) и в последовательно (приводящие к уменьшению длины мышечных волокон), является следствием уменьшения синтеза белка, которое возникает при старении и неиспользовании (см. следующий раздел). Несколько факторов могут вызвать депрессию в путях передачи сигналов белка (49,50), и как было недавно показано, один из молекулярных модуляторов этого процесса является механочувствительная белковая фокусадгезионная киназа (FAK), расположенная в регионе костамеров мышечных волокон и, как известно, чувствительна к изменениям механической нагрузки. После 10 дней разгрузки разгибателей колена у человека было обнаружено, что содержание и активность FAK снижаются на 20 и 30%, соответственно (51), что приводит к 50% -ному падению синтеза белка и к 6% уменьшению длины волокна, что эквивалентно потере 2700 саркомеров (50).
Этиология саркопении
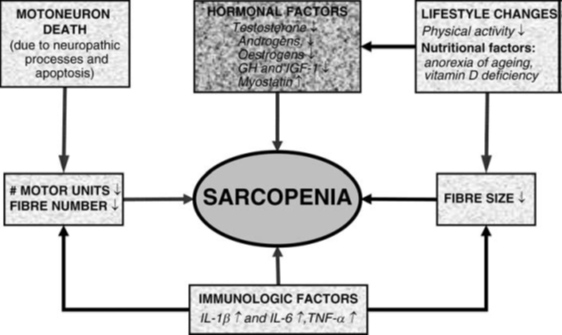
Этиология саркопении является достаточно сложной, поскольку она включает в себя центральные и периферические изменения нервной системы, гормонов, питательных, иммунологических и физических изменений активности (Рис. 1). Среди этих факторов, невропатические процессы являются, пожалуй, одной из самых важных причин, поскольку они несут ответственность за дистрофию α-мотонейронов денервацию мышечных волокон, что приводит к потере двигательных единиц. На протяжении всей жизни, скелетные мышцы проходят непрерывный цикл денервация и реиннервация (53), но в старости кажется, что процесс реиннервации не может идти в ногу с денервацией, что способствует потере двигательных единиц. Хотя не проводилось длительных исследований, чтобы определить временной ход этих событий, поперечные (кросс-секционные) исследования позволяют предположить, что количество мотонейронов или двигательных единиц поддерживается до 70-летнего возраста. Однако затем этот показатель снижается очень быстро (32). Точные причины этой возрастной потери мотонейронов, еще предстоит выяснить, но недавние исследования на грызунах показали, что возрастное снижение синтеза цилиарного нейротрофического фактора (CNTF) – белка, который способствует дифференциации и выживанию мотонейронов, связано с дегенерацией мотонейронов. Некоторые денервации мышечных волокон, в основном II типа, являются реиннервацией через аксоны волокон мышечных волокон I типа (33,55,56). Это порождает увеличение количества ДЕ, характеризующихся очень большим потенциалом действия. Хотя это дает небольшую компенсацию потери силы, и увеличивает иннервационное соотношение пораженных ДЕ, тем самым снижая точный контроль силы во время работы ДЕ.
Дегенеративные изменения нервной системы также относятся к нервно-мышечному соединению, , которое со старением подвергается значительному ремоделированию и фрагментации. Дегенеративные изменения в этих структурах включают фрагментацию в распределении рецепторов ацетилхолина и увеличение сферы действия областей или частей, которые пространственно разделены или соединены только тонкими нервными волокнами, доводящие разделения до конца (обзор см. ссылки (53, 57)). Недавние эксперименты на трансгенных мышах, лишенных антиоксидантного фермента супероксид дисмутазы показали ускорение саркопении из-за нервно-мышечной дегенерации следующей митохондриальной дисфункции. Эта находка указывает на то, что снижение способности справиться с увеличением окислительного стресса может быть, по крайней мере у грызунов, важной причиной саркопении (58).
Дегенеративные изменения в нервно-мышечной системе также могут влиять непосредственно на сами мышечные волокна независимо от нейропатических прцессов, так как появляется все больше доказательств того, что апоптоз мышечных волокон способствует саркопении (59). Митохондриальная дисфункция и стресс саркоплазматического ретикулума, кажется, играют ключевую роль в стимулировании апоптоза мышечных волокон. Активные формы кислорода, такие как как супероксид анион и перекись водорода, как полагают, играют ключевую роль, вызывая такие последствия (60, 61). Производство митохондриальных активных форм кислорода, как полагают, увеличивается с возрастом из-за изменений функций дыхательной цепи и уменьшения клеточного щита от свободных радикалов, вызывающих повреждение митохондриального ДНК (мтДНК) (62). До недавнего времени было мало доказательств причин связей между мтДНК и дисфункцией мышечной ткани, но в 2004 году Trifunovac et al. (63) показали, что соматические мутации мтДНК, связаны с преждевременным началом старения, и вызывают остеохондроз, гипертрофию миокарда и саркопению.
Апоптоз мышечных волокон может быть вызван активацией определенных сигнальных путей, инициированных связыванием лигандов факторов некроза опухоли альфа (TNF-a) в мембранных рецепторах с участием каспазного каскада (эндопротеазы), отвечающего за протеолитические события, в результате которых происходит распад и смерть клетки. Кроме того, митохондрии, обычно рассматриваются как основной регулятор апоптоза (59), который может быть вызван несколькими различными путями: посредством освобождения цитохрома С в цитозоль, ведущего к активации эффекторных каспаз, а также через выпуск белков, связывающих одноцепочечную ДНК (Pro-apoptotic), ведущих к фрагментации ДНК. К апоптозу может привести стресс эндоплазматического ретикулума, который ведет к выходу кальция в саркоплазмы, что, в конечном итоге, и приводит к активации эффекторных каспаз. Хотя определить конкретную роль апоптоза в саркопении достаточно, но так как вес мышц был определён как обратно пропорциональный частоте возникновения апоптоза, который выражается в росте индекса апоптоза (59), можно предположить, что между ними есть причинно – следственная связь.
В результате гибели мотонейронов, вследствие нейропатических процессов и апоптоза мышечных клеток, количество мышечных волокон с возрастом значительно уменьшается (25). С возрастом также уменьшается размер волокна, то есть происходит его атрофия. Это происходит из-за снижения пролиферации сателлитных клеток, что в свою очередь связано с возрастным снижением факторов роста, таких как ИФР-1 (64) и уменьшением механических воздействий, а также из-за снижения физической активности. Последние данные свидетельствуют о том, что физически активные люди, в возрасте 70-79, на 20% менее активны своих 20-29 летних коллег (6). Кроме того, снижение мышечной активности может также привести апоптозу мышечных волокон, как это было обнаружено у крыс, подвешенных за задние конечности (65). Тем не менее, связанная с возрастом потеря мышечной массы менее заметна у спортсменов, занимающихся на протяжение всей жизни (спортсменов-мастеров). У них больше волокон I, IIA и IIB типа, чем у людей такого же возраста, но нетренированных (66). Защитный эффект высокой физической активности против потери мышц спортсменов- мастеров, замедляет, но не предотвращает снижение производительности мышц, которая от20 до 80 лет, падает примерно на 40% у бегунов на выносливость, на 60% у тяжелоатлетов (67). По данному факту Korhonen и др. (66) сравнил более возрастных и молодых спринтеров, и обнаружил, что спортсмены пожилого возраста показали типичное возрастное уменьшение размеров быстрых волокон, с переходом в более медленную MHC изоформу и снижение VO волокон MHC I типа. Вместе с этим, специфическое напряжение волокон I и II типа не отличалось у возрастных и молодых спринтеров (66). Они пришли к выводу, что эти изменения, вероятно, сыграли роль в снижении взрывной силы, наблюдаемой у спринтеров старшего возраста. Следовательно эти данные свидетельствуют о том, что регулярная, интенсивная физическая активность предотвращает или полностью компенсирует возрастные изменения мышечной массы, приводя к гипертрофии уцелевших мышечных волокон, но полностью компенсировать потерю волокон из за невропатических процессов и замедления молекул миозина маловероятно. Последнее, по-видимому, не происходит из за снижения уровня физической активности, так как это наблюдается и при сидячем образе жизни и у высокоактивных возрастных спринтеров, более вероятно, это происходит из-за посттрансляционных модификаций сократительных белков. Среди них, в связи со старением увеличивается неферментативная гликация молекулы миозина, связанная с замедлением его внутренней скорости сокращения, наблюдаемая in vitro при анализе моторики (68).
Помимо нейропатии и изменений, связанных с физической активностью, питание, гормональные и иммунологические факторы также способствуют саркопении. Плохое питание в процессе старения довольно частый случай, и это связано с прогрессивной потерей аппетита, снижением потребления пищи, а также дефиците витамина D, в значительной степени это приводит к атрофии кожи (69). Кроме того, низкий уровень витамина D, в сочетании с высоким уровнем паратиреоидного гормона, способствует увеличению риска потери мышечной массы (атрофии мышц) в пожилом возрасте (70,71).
Гормональные и иммунологические изменения касающиеся саркопении, представлены выводами сопротивляемости к этим факторам ответственных за анаболизм (снижение уровня GH, IGF-1, тестостерона) и повышению катаболической активности (повышение уровня IL-1, IL-6TNF- a, миостатина) (72).
Белковый обмен
Несмотря на то, что сложно определить вклад каждого из факторов, перечисленных выше, можно в целом сказать, что саркопения – это результат дисбаланса между синтезом и разрушением белка. Было установлено, что у людей базальный распад белка либо остаётся неизменным, либо немного повышается с возрастом (76), и, что удивительно, в базальном синтезе белка у молодых и взрослых испытуемых различий не наблюдается (76-78). Однако, различия в синтезе белка у молодых и взрослых испытуемых всё же существуют в ответе на питание или физические нагрузки. Установлено, что у пожилых людей наблюдается притупленная реакция на анаболические стимулы. В отличие от молодых испытуемых, у пожилых людей наблюдается меньший подъём синтеза мышечного белка при употреблении аминокислот при инсулиновом клэмпе ( -40%), а также в срочном тренировочном ответе на нагрузку (-30%) (79).
Также, несмотря на отсутствие различий в распаде белка в базальном состоянии, важные различия были обнаружены во время приёма пищи. Wilkes и др. (80) заявили, что пожилых людей в отличие от молодых происходит прерывание распада белка инсулином во время приёма пищи и активация Аkt-протеинкиназного В метаболического пути. Эти эффекты были обнаружены, когда молодым и взрослым испытуемым предлагали пищу с низким гликемическим индексом и измеряли белковый обмен в ногах (используя метод артериовенозного изотопного разбавления) и синтез мышечного белка после введения стабильных изотопов аминокислот. Катаболизм белков был выявлен в том случае, когда избыточное выделение белка артерий и вен ног увеличился потоком плазмы. В то время, как не наблюдалось никакой разницы между базальным распадом белка ног (LBP) у пожилых и молодых людей, во время приема пищи обнаружился спад LBP на 12% у пожилых людей под воздействием инсулина и на 47% у молодых. Подводя итог, эти результаты указывают на то, что саркопения у людей проявляется не только из-за притупленной анаболической реакции (уменьшенная чувствительность и время реакции) на поступление с пищей аминокислот, но также и из-за сниженной чувствительности к тормозящему распад белка действию инсулина. При том, что наблюдалось повышение распада белка при активации системы убиквитин-протеасом (UBP) у старых крыс (81), применять эти открытия на людях довольно рисковано, так как у этих двух видов присутствуют существенные различия в процессе белкового обмена (82). Роль UBP при мышечной атрофии у людей была недавно подробно описана Murton и др (83). В целом, доступные данные показывают, что активация убикватин-лигаз MAFbx/atrogin-1 и MuRF1 в основном происходит при мышечной атрофии, вызванной воспалительными процессами (такими как при онкологии, ХНЗЛ, критические заболевания, серьёзные травмы, амитрофичекском латеральном склерозе, СПИДе). В отличие от этого, данные об изменениях в экспрессии MAFbx/atrogin-1 и MuRF1 mRNAs, и белка при невоспалительной мышечной атрофии являются непостоянными (83) и ставят под вопрос роль UBP при мышечной атрофии у здоровых испытуемых. Роль UBP при невоспалительной мышечной атрофии также ставится под вопрос во время наблюдений, при которых не обнаруживается изменение в распаде белка при инсулин-стимулированных изменениях экспрессии атрогина-1 и MuRF1 (84)
Даже принимая во внимание то, что UBP имеет место быть при саркопении, доступные данные показывают лишь небольшой подъем в базальном распаде белка у людей (76).
Характеристика регенерации мышц
Клетки-сателлиты – это неподвижные миогенные прекурсоры, играющие основную роль в восстановлении мышц и их росте (85). Отслеживая повреждение, клетки-сателлиты активизируются и делятся превращаясь в миобласты. Если базальная мембрана неповреждена, миобласты соединяясь друг с другом формируют мышечные трубочки, которые затем превращаются в новое волокно или присоединяются к уже существующим мышечным волокнам. Таким образом восстанавливая мышечное волокно. Недавние исследования показывают, что промежуточным звеном в фрагментации неподвижности клеток-сатиллитов и инициации пролиферации ( размножения) является сигнальный путь Notch. С возрастом, активация сигнального пути Notch ухудшается из-за снижения активности (МАРК) (митоген-активируемая протеинкиназа), таким образом ухудшая активацию клетки-сателлита. Этот процесс сопровождается увеличением уровня трансформирующего фактора роста (TGF — b), который является причиной накопления циклин-зависимой киназы, которая в свою очередь тормозит активность клеток-сателлитов и препятствует их регенеративному ответу на повреждение.
Функциональные последствия саркопении
Есть множество исследований, доказывающие снижение силы и мощности мышц в старости (см обзор 87). Процент потери мощности мышц составляет примерно 3–4% в год, однако, он в 2 раза больше, чем процент потери изометрической силы (1–2%/год) (88). Следовательно, сравнивая значения изометрической силы и пиковой мощности пожилых людей средний возраст которых 74 года, и более молодых людей средний возраст которых 26 лет, выявлено 40%-е различие в изометрической силе, против 60%-е различие в пиковой мощности (47).
С функциональной точки зрения, большее снижение мощности мышц, чем в силы, имеет значительные последствия для качества жизни пожилых людей, так как большинство ежедневных действий, таких как, подъем со стула или восхождение на лестничный пролет требуют развития мощности мышц. Эта проблема более выражена у пожилых страдающих ожирением людей, так как у них идет ежегодное уменьшение мышечной массы, и энергии для повседневной деятельности меньше, но их организм должен генерировать дополнительную мощность, и таким образом использовать больше энергии, чтобы преодолеть избыток жира из их организма.. Несмотря на то, что саркопения является главным фактором, определяющим слабость мышцы в старости, потеря силы мышц и мощности, превышает уменьшение размера и объема мышц и, как следствие, идет снижение отношения силы мышц к площади поперечного сечения, и максимальной мощности относительно объема мышц (6,8,9,28,89). (Сила мышцы зависит от площади ее поперечного сечения (ППС), то есть, от количества производящих силу саркомеров, расположенных параллельно, в то время как мощность, будучи продуктом силы и скорости, зависит от количества саркомеров, расположенных последовательно то есть зависит от объема мышц, который является произведением длины мышц и площади поперечного сечения).
Несколько факторов способствуют этому явлению, часто называемых ухудшением в «качестве мышц». Эти факторы может быть сгруппированы по двум главными категориями: нейромышечный и сухожильный. Каждый из этих факторов обсужден отдельно в следующих параграфах.
Потери в площади поперечного сечения мышц
Среди изменений в мышцах уменьшение силы одиночного волокна относительно площади поперечного сечения (удельное натяжение) является одним из основных факторов, способствующих уменьшению внутренней силы мышц и недавние доказательства предполагают, что это тесно связано с уменьшением числа актомиозиновых поперечных мостиков, а не в силе, оказываемой каждым поперечным мостиком (30). Уменьшение взаимодействия между возбуждением и сокращением также может способствовать к уменьшению удельного напряжения, поскольку все больше доказательств изменения этого соотношения в пожилом возрасте (90,91). При старении скелетной мышцы было обнаружено снижение функции дегидропиридиновых рецепторов, приводящих к уменьшению выделения ионов кальция из саркоплазматического (57). Другой причиной снижения удельного напряжения одиночного волокна по мере старения является глицинация белка. В нескольких исследованиях показано накопление конечных продуктов гликирования (AGE) по мере старения. Было показано, что эти продукты изменяют структурные и функциональные свойства сократительного белка миозина, что приводит к уменьшению максимальной скорости сокращения и удельного напряжения, а также к увеличению внутримышечного связей коллагена (93), которое, как полагают, связано с повышенной мышечной жесткость и нарушению функции мышц у пожилых людей. Накопление (AGE) особенно часто встречается при диабете и у людей с низким уровнем физической активности (93).
Изменения в мощности
На мощность мышц влияют изменения как силы, так и скорости укорочения. В дополнение к перечисленным выше причинам потери в мышцах силы (вместе с изменениями в нейронном обеспечении в случае произвольного сокращения, см. ниже), факторы, способствующие уменьшению скорость укорочения в старости — это выборочная потеря быстрых мышечных волокон (чья мощность примерно в 10 раз выше, чем у медленных волокон) (94) и уменьшение собственной скорости сокращения молекулы миозина (68).
Изменения в нервном возбуждении
Несколько исследователей обнаружили уменьшенную способность к активации у пожилых людей (10, 95, 96), в то время как другие не сообщили ни о каких различиях (97-99), хотя общепризнанно, что среди мышц существует различная способность к активации (100). Частота активации ДЕ, как и их рекрутирование были уменьшены у пожилых людей (101), хотя более низкая частота импульсации не обязательно приводит к уменьшению активности, так как частота активации ДЕ уменьшена со старением из-за увеличения длительности сокращения. В качестве возможного механизма потери силы по мере старения можно рассмотреть увеличенную кoактивацию мышц-антагонистов, которая вероятно необходима для стабилизации суставов.
Изменения в сухожилиях
Старение не только включает в себя качественные и количественные изменения скелетных мышц, но также и сухожилий. Механические свойства сухожилия, изученные подробно с использованием ультразвукового обследования, значительно ухудшаются в старости (103). Эти изменения представлены уменьшением жесткости сухожилия (-36%) и модуля Юнга (-48%) предполагающие, что ухудшение в свойствах материала сухожилия составляет большую часть снижения жесткости. Эти изменения в свойствах сухожилия со старостью, как ожидается, оказывают прямое влияние на мышцу, ее механические свойства: степень сокращения мышечных волокон и развитие силы после сокращения (10). Это вызвано тем, что уменьшение жесткости сухожилия заставляет мышечные волокна больше укорачиваться после сокращения, для того чтобы поднять более слабое сухожилие. Это большее укорочение после сокращения может поместить пучки волокон в неблагоприятную часть отношения «длина-напряжение» и может, таким образом способствовать потере внутренней силы мышц со старением. Несмотря на эти более ранние результаты возрастных уменьшений жесткости сухожилия и модулю Юнга, в последнее время не обнаружено различий между молодыми и пожилыми людьми (104).
Заключение
У саркопении сложная этиология, включающая в себя механизмы нейронной, гормональной, иммунологической, пищевой и физической активности. Хотя этот процесс затрагивает оба пола, женщины больше подвергаются риску потери функциональной самостоятельности, чем мужчины — так как они живут дольше, и в любом возрасте имеют более низкую массу мышц, чем мужчины, а также потому, что они показывают большее притупление анаболической реакции на физическую нагрузку и питание в дополнение к притуплению антипротеолитического эффекта инсулина. Однако масса мышц в старости не только теряется из-за уменьшенного анаболизма и увеличенного катаболизма, но также и из-за сниженной производительности регенерации мышц посредством клеток-сателлитов в старости. Наконец, увеличенное распространение ожирения в более старом возрасте населения — признанный фактор сложения процентов саркопении, порождая собой условие, которое, вероятно, способствует потере массы мышц, подвижности и самостоятельности в старости.
Перспективы
Несмотря на значительный объем знаний, которые были накоплены по изучению распространенности, этиологии и функциональных последствий саркопении, остается много необъясненного. Например, следует отделить эффекты старения как такового от неиспользования и болезней. Большинство имеющихся знаний в этой области базируется на смежных исследованиях, сравнивающих молодых и пожилых людей с различными генетическими и фенотипическими особенностями, таким образом, можно предполагать, что те же самые определяющие факторы стимулируют процесс старения различных людей. Необходимы также более продолжительные исследования, особенно, при этом необходимо обращать особое внимание к выбору представительного фенотипа или минимального набора фенотипов, влияющих на различные характеристики (силу, утомляемость, мощность, вестибулярную устойчивость и координацию). Будущие исследователи должны также попытаться разъяснить роль распада мышечного белка с медицинской точки зрения у клинически-стабильных пожилых людей, поскольку множество существующих представлений о непосредственных причинах атрофии неоправданно акцентирует его роль. На самом деле нет никаких доказательств того, что у пожилых людей повышен распад белка. К тому же ни один из так называемых протеолитических маркеров не был достаточно проверен. Кроме того, доказательства активации АТФ зависимого убиквитин (кисло-белкового)-протеасомного пути (и других проводящих путей с участием каспазы и аутофагов) поступают в основном из повышенной экспрессии иРНК (измерена ферментативная активность без белка) и вытекает из исследований грызунов с различной картиной протекания синтеза белка, в отличие от наблюдений на людей. У людей, доказательства активации UPS вытекает из исследований, проведенных на худых (болезненных) пациентах, которые могут показывать более быстрый и другой режим потери мышц, характеризующей активацией катаболических гормонов и воспаления. Хотя существуют убедительные доказательства того, что регулярные силовые тренировки замедляют старение, связанное со снижением мышечной массы, однако их возможная роль в защите от потери двигательных единиц должна быть дополнительно изучена. Другие возможные методы лечения, заслуживающие внимания включают использование селективных (отборных) молекул рецептора андрогена и антимиостатиновые антитела, оба из которых в настоящее время находятся во II стадии испытаний в США. Возможно, активацию клеток сателлитов можно стимулировать посредством фармакологии. И наконец, нужно точное понимание незначительного анаболического ответа на силовые упражнения пожилых женщин.
References
- Rosenberg IH. Sarcopenia: origins and clinical relevance. J Nutr 1997;127: 990 S–1.
- Janssen I, Heymsfield SB, Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J Am Geriatr Soc 2002; 50:889–96.
- Janssen I, Heymsfield SB, Wang ZM et al. Skeletal muscle mass and distribution in 468 men and women aged 18–88 yr. J Appl Physiol 2000;89:81–8.
- Ryan AS, Dobrovolny CL, Smith GV et al. Hemiparetic muscle atrophy and increased intramuscular fat in stroke patients. Arch Phys Med Rehabil 2002; 83:1703–7.
- Gallagher D, Visser M, De Meersman RE et al. Appendicular skeletal muscle mass: effects of age, gender, and ethnicity. J Appl Physiol 1997;83: 229–39.
- Morse CI, Thom JM, Davis MG et al. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. Eur J Appl Physiol 2004; 92:219–26.
- Galea V. Changes in motor unit estimates with aging. J Clin Neurophysiol 1996; 13:253–60.
- Young A, Stokes M, Crowe M. The size and strength of the quadriceps muscles of old and young men. Clin Physiol 1985; 5:145–54.
- Jubrias SA, Odderson IR, Esselman PC et al. Decline in isokinetic force with age: muscle cross-sectional area and specific force. Pflugers Arch 1997; 434:246–53.
- Harridge SD, Kryger A, Stensgaard A. Knee extensor strength, activation, and size in very elderly people following strength training. Muscle Nerve 1999; 22:831–9.
- Taaffe DR, Henwood TR, Nalls MA et al. Alterations in muscle attenuation following detraining and retraining in resistance-trained older adults. Gerontology 2009; 55:217–23.
- Kent-Braun JA, Ng AV, Young K. Skeletal muscle contractile and noncontractile components in young and older women and men. J Appl Physiol 2000; 88:662–8.
- Sipila S, Suominen H. Knee extension strength and walking speed in relation to quadriceps muscle composition and training in elderly women. Clin Physiol 1994; 14:433–42.
- Baumgartner RN. Body composition in healthy aging. Ann N Y Acad Sci 2000;904: 437–48.
- Neels JG, Olefsky JM. Inflamed fat: what starts the fire? J Clin Invest 2006; 116:33–5.
- Goodpaster BH, Krishnaswami S, Resnick H et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care 2003; 26:372–9.
- Goodpaster BH, Thaete FL, Kelley DE. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. Am J Clin Nutr 2000;71: 885–92.
- Reaven GM, Chen YD. Role of insulin in regulation of lipoprotein metabolism in diabetes. Diabetes Metab Rev 1988;4: 639–52.
- Stenholm S, Harris TB, Rantanen T et al. Sarcopenic obesity: definition, cause and consequences. Curr Opin Clin Nutr Metab Care 2008; 11:693–700.
- Roubenoff R. Sarcopenic obesity: the confluence of two epidemics. Obes Res 2004; 12:887–8.
- Larsson L, Sjodin B, Karlsson J. Histochemical and biochemical changes in human skeletal muscle with age in sedentary males, age 22–65 years. Acta Physiol Scand 1978; 103:31–9.
- Lexell J, Henriksson-Larsen K, Winblad B et al. Distribution of different fiber types in human skeletal muscles: effects of aging studied in whole muscle cross sections. Muscle Nerve 1983; 6:588–95.
- Klitgaard H, Zhou M, Schiaffino S et al. Ageing alters the myosin heavy chain composition of single fibres from human skeletal muscle. Acta Physiol Scand 1990; 140:55–62.
- Larsson L. Morphological and functional characteristics of the ageing skeletal muscle in man. A cross-sectional study. Acta Physiol Scand Suppl 1978; 457:1–36.
- Lexell J, Taylor CC, Sjostrom M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci 1988; 84:275–94.
- Coggan AR, Spina RJ, King DS et al. Histochemical and enzymatic comparison of the gastrocnemius muscle of young and elderly men and women. J Gerontol 1992;47: B71–6.
- Andersen JL. Muscle fibre type adaptation in the elderly human muscle. Scand J Med Sci Sports 2003;13: 40–7.
- Klitgaard H, Mantoni M, Schiaffino S et al. Function, morphology and protein expression of ageing skeletal muscle: a cross-sectional study of elderly men with different training backgrounds. Acta Physiol Scand 1990; 140:41–54.
- Klitgaard H, Bergman O, Betto R et al. Co-existence of myosin heavy chain I and IIa isoforms in human skeletal muscle fibres with endurance training. Pflugers Arch 1990;416: 470–2.
- D’Antona G, Pellegrino MA, Adami R et al. The effect of ageing and immobilization on structure and function of human skeletal muscle fibres. J Physiol 2003; 552:499–511.
- D’Antona G, Pellegrino MA, Carlizzi CN et al. Deterioration of contractile properties of muscle fibres in elderly subjects is modulated by the level of physical activity. Eur J Appl Physiol 2007; 100:603–11.
- Campbell MJ, McComas AJ, Petito F. Physiological changes in ageing muscles. J Neurol Neurosurg Psychiatry 1973; 36:174–82.
- Lexell J. Human aging, muscle mass, and fiber type composition. J Gerontol A Biol Sci Med Sci 1995;50: 11–6.
- Fluck M, Hoppeler H. Molecular basis of skeletal muscle plasticity–from gene to form and function. Rev Physiol Biochem Pharmacol 2003; 146:159–216.
- Liu Y, Schlumberger A, Wirth K et al. Different effects on human skeletal myosin heavy chain isoform expression: strength vs. combination training. J Appl Physiol 2003;94:2282–8.
- Brooks SV, Faulkner JA. Contractile properties of skeletal muscles from young, adult and aged mice. J Physiol 1988; 404:71–82.
- Narici MV, Bordini M, Cerretelli P. Effect of aging on human adductor pollicis muscle function. J Appl Physiol 1991;71: 1277–81.
- Lexell J, Downham D, Sjostrom M. Distribution of different fibre types in human skeletal muscles. Fibre type arrangement in m. vastus lateralis from three groups of healthy men between 15 and 83 years. J Neurol Sci 1986;72: 211–22.
- Frontera WR, Hughes VA, Fielding RA et al. Aging of skeletal muscle: a 12-yr longitudinal study. J Appl Physiol 2000;88: 1321–6.
- Hall ZW, Ralston E. Nuclear domains in muscle cells. Cell 1989;59: 771–2.
- Gundersen K, Bruusgaard JC. Nuclear domains during muscle atrophy: nuclei lost or paradigm lost? J Physiol 2008; 586:2675–81.
- Wada KI, Takahashi H, Katsuta S et al. No decrease in myonuclear number after long-term denervation in mature mice. Am J Physiol Cell Physiol 2002;283:C484–8.
- Kadi F, Charifi N, Denis C et al. Satellite cells and myonuclei in young and elderly women and men. Muscle Nerve 2004; 29:120–7.
- Brack AS, Bildsoe H, Hughes SM. Evidence that satellite cell decrement contributes to preferential decline in nuclear number from large fibres during murine age-related muscle atrophy. J Cell Sci 2005;118: 4813–21.
- Lieber RL, Friden J. Functional and clinical significance of skeletal muscle architecture. Muscle Nerve 2000;23: 1647–66.
- Narici MV, Maganaris CN, Reeves ND et al. Effect of aging on human muscle architecture. J Appl Physiol 2003;95: 2229–34.
- Thom JM, Morse CI, Birch KM et al. Influence of muscle architecture on the torque and power-velocity characteristics of young and elderly men. Eur J Appl Physiol 2007; 100:613–9.
- Kawakami Y, Abe T, Fukunaga T. Muscle-fiber pennation angles are greater in hypertrophied than in normal muscles. J Appl Physiol 1993; 74:2740–4.
- Rennie MJ, Wackerhage H, Spangenburg EE et al. Control of the size of the human muscle mass. Annu Rev Physiol 2004;66: 799–828.
- de Boer MD, Maganaris CN, Seynnes OR et al. Time course of muscular neural tendinous adaptations to 23 day unilateral lower-limb suspension in young men. J Physiol 2007;583: 1079–91.
- de Boer MD, Selby A, Atherton P et al. The temporal responses of protein synthesis, gene expression and cell signalling in human quadriceps muscle and patellar tendon to disuse. J Physiol 2007;585: 241–51.
- Brown WF. A method for estimating the number of motor units in thenar muscles and the changes in motor unit count with ageing. J Neurol Neurosurg Psychiatry 1972;35: 845–52.
- Luff AR. Age-associated changes in the innervation of muscle fibers and changes in the mechanical properties of motor units. Ann N Y Acad Sci 1998;854: 92–101.
- Guillet C, Auguste P, Mayo W et al. Ciliary neurotrophic factor is a regulator of muscular strength in aging. J Neurosci 1999; 19:1257–62.
- Larsson L, Ansved T. Effects of ageing on the motor unit. Prog Neurobiol 1995;45: 397–458.
- Frey D, Schneider C, Xu L et al. Early and selective loss of neuromuscular synapse subtypes with low sprouting competence in motoneuron diseases. J Neurosci 2000; 20:2534–42.
- Delbono O. Neural control of aging skeletal muscle. Aging Cell 2003; 2:21–9.
- Jang YC, Lustgarten MS, Liu Y et al. Increased superoxide in vivo accelerates age-associated muscle atrophy through mitochondrial dysfunction and neuromuscular junction degeneration. FASEB J
- Dirks AJ, Leeuwenburgh C. The role of apoptosis in age-related skeletal muscle atrophy. Sports Med 2005; 35:473–83.
- Drew B, Phaneuf S, Dirks A et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. Am J Physiol Regul Integr Comp Physiol 2003;284: R474–80.
- Short KR, Bigelow ML, Kahl J et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proc Natl Acad Sci USA 2005;102: 5618–23.
- Harman D. Aging: a theory based on free radical and radiation chemistry. J Gerontol 1956;11: 298–300.
- Trifunovic A, Wredenberg A, Falkenberg M et al. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature 2004;429: 417–23.
- Barton-Davis ER, Shoturma DI, Sweeney HL. Contribution of satellite cells to IGF-I induced hypertrophy of skeletal muscle. Acta Physiol Scand 1999;167: 301–5.
- Allen DL, Linderman JK, Roy RR et al. Apoptosis: a mechanism contributing to remodeling of skeletal muscle in response to hindlimb unweighting. Am J Physiol 1997;273:C579–87.
- Korhonen MT, Cristea A, Alen M et al. Aging, muscle fiber type, and contractile function in sprint-trained athletes. J Appl Physiol 2006;101: 906–17.
- Faulkner JA, Larkin LM, Claflin DR et al. Age-related changes in the structure and function of skeletal muscles. Clin Exp Pharmacol Physiol 2007;34: 1091–6.
- Hook P, Sriramoju V, Larsson L. Effects of aging on actin sliding speed on myosin from single skeletal muscle cells of mice, rats, and humans. Am J Physiol Cell Physiol 2001;280:C782–8.
- Tawa NE, Goldberg AL. Protein and amino acid metabolism in muscle. In Engel A, GaF AG (eds). Myology, Vol. 1, 2nd edn. New York: McGraw Hill, 1994,683–707.
- Visser M, Deeg DJ, Lips P. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam. J Clin Endocrinol Metab 2003;88: 5766–72.
- Schacht E. Rationale for treatment of involutional osteoporosis in women and for prevention and treatment of corticosteroid-induced osteoporosis with alfacalcidol. Calcif Tissue Int 1999;65: 317–27.
- Doherty TJ. Invited review: aging and sarcopenia. J Appl Physiol 2003;95: 1717–27.
- Volpi E, Rasmussen BB. Nutrition and muscle protein metabolism in the elderly. Diabetes Nutr Metab 2000;13: 99–107.
- Welle S, Thornton C, Statt M. Myofibrillar protein synthesis in young and old human subjects after three months of resistance training. Am J Physiol 1995;268: E422–7.
- Balagopal P, Rooyackers OE, Adey DB et al. Effects of aging on in vivo synthesis of skeletal muscle myosin heavy-chain and sarcoplasmic protein in humans. Am J Physiol 1997;273: E790–800.
- Volpi E, Sheffield-Moore M, Rasmussen BB et al. Basal muscle amino acid kinetics and protein synthesis in healthy young and older men. JAMA 2001;286: 1206–12.
- Volpi E, Mittendorfer B, Rasmussen BB et al. The response of muscle protein anabolism to combined hyperaminoacidemia and glucose-induced hyperinsulinemia is impaired in the elderly. J Clin Endocrinol Metab 2000;85: 4481–90.
- Cuthbertson D, Smith K, Babraj J et al. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J 2005;19: 422–4.
- Cuthbertson DJ, Babraj J, Smith K et al. Anabolic signaling and protein synthesis in human skeletal muscle after dynamic shortening or lengthening exercise. Am J Physiol Endocrinol Metab 2006;290: E731–8.
- Wilkes EA, Selby AL, Atherton PJ et al. Blunting of insulin inhibition of proteolysis in legs of older subjects may contribute to age-related sarcopenia. Am J Clin Nutr 2009;90: 1343–50.
- Combaret L, Dardevet D, Rieu I et al. A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle. J Physiol 2005;569: 489–99.
- Rennie MJ, Selby A, Atherton P et al. Facts, noise and wishful thinking: muscle protein turnover in aging and human disuse atrophy. Scand J Med Sci Sports
- Murton AJ, Constantin D, Greenhaff PL. The involvement of the ubiquitin proteasome system in human skeletal muscle remodelling and atrophy. Biochim Biophys Acta 2008;1782: 730–43.
- Greenhaff PL, Karagounis LG, Peirce N et al. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin ligases, and protein turnover in human muscle. Am J Physiol Endocrinol Metab 2008;295: E595–604.
- Grounds MD. Muscle regeneration: molecular aspects and therapeutic implications. Curr Opin Neurol 1999;12: 535–43.
- Carlson ME, Suetta C, Conboy MJ et al. Molecular aging and rejuvenation of human muscle stem cells. Embo Mol Med 2009; 1:1–11.
- Macaluso A, De Vito G. Muscle strength, power and adaptations to resistance training in older people. Eur J Appl Physiol 2004;91: 450–72.
- Skelton DA, Greig CA, Davies JM et al. Strength, power and related functional ability of healthy people aged 65–89 years. Age Ageing 1994;23: 371–7.
- Macaluso A, Nimmo MA, Foster JE et al. Contractile muscle volume and agonist-antagonist coactivation account for differences in torque between young and older women. Muscle Nerve 2002;25: 858–63.
- Delbono O, O’Rourke KS, Ettinger WH. Excitation-calcium release uncoupling in aged single human skeletal muscle fibers. J Membr Biol 1995;148: 211–22.
- Payne AM, Delbono O. Neurogenesis of excitation-contraction uncoupling in aging skeletal muscle. Exerc Sport Sci Rev 2004;32: 36–40.
- Ramamurthy B, Hook P, Jones AD et al. Changes in myosin structure and function in response to glycation. FASEB J 2001;15: 2415–22.
- Haus JM, Carrithers JA, Trappe SW et al. Collagen, cross-linking, and advanced glycation end products in aging human skeletal muscle. J Appl Physiol 2007;103: 2068–76.
- Bottinelli R, Reggiani C. Human skeletal muscle fibres: molecular and functional diversity. Prog Biophys Mol Biol 2000;73: 195–262.
- Yue GH, Ranganathan VK, Siemionow V et al. Older adults exhibit a reduced ability to fully activate their biceps brachii muscle. J Gerontol A Biol Sci Med Sci 1999;54:M249–53.
- Scaglioni G, Ferri A, Minetti AE et al. Plantar flexor activation capacity and H reflex in older adults: adaptations to strength training. J Appl Physiol 2002;92: 2292–302.
- Phillips SK, Bruce SA, Newton D et al. The weakness of old age is not due to failure of muscle activation. J Gerontol 1992;47:M45–9.
- De Serres SJ, Enoka RM. Older adults can maximally activate the biceps brachii muscle by voluntary command. J Appl Physiol 1998;84: 284–91.
- Kent-Braun JA, Ng AV. Specific strength and voluntary muscle activation in young and elderly women and men. J Appl Physiol 1999;87: 22–9.
- Dowling JJ, Konert E, Ljucovic P et al. Are humans able to voluntarily elicit maximum muscle force? Neurosci Lett 1994;179: 25–8.
- Kamen G, Sison SV, Du CC et al. Motor unit discharge behavior in older adults during maximal-effort contractions. J Appl Physiol 1995;79: 1908–13.
- de Boer MD, Morse CI, Thom JM et al. Changes in antagonist muscles’ coactivation in response to strength training in older women. J Gerontol A Biol Sci Med Sci 2007;62: 1022–7.
- Narici MV, Maganaris CN. Plasticity of the muscle-tendon complex with disuse and aging. Exerc Sport Sci Rev 2007;35: 126–34.
- Couppe C, Hansen P, Kongsgaard M et al. Mechanical properties and collagen cross-linking of the patellar tendon in old and young men. J Appl Physiol 2009;107: 880–6.
Перевод осуществляли магистранты
Введение – Артемьева С.А., Озёркин А.Е.
Определение саркопении – Озёркин А.Е.
Эпидемиология саркопении – Кузнецов А.А.
Региональное распространение саркопении – Кузнецов А.А.
Внутримышечное накопление жира и саркопеническое ожирение – Помыканова А.Д.
Размер мышечных волокон, их количество и композиция – Панчишина Д.Ю.. Бурангулов А.Ф.
Клетки-сателлиты и мионуклеарный домен – Тарабрина М.Д.
Изменение в мышечной архитектуре – Волкова В.В.. Сахарова Ю.С.
Этоология саркопении – Гарибяйте К.Е., Яковлева Е.Д., Щетрова Т.А., Баруздин Д.Э., Катренко
Белковый обмен, характеристика регенерации мышц – Артамонова А.И.
Функциональные последствия саркопении – Комзарова Т.Е.
Изменения в нервном управлении, изменения в сухожилиях – Мартыненкова В.С.
Заключение, перспективы – Омельчук Л.А., Калинкин Н.Н.
Редакция текста – А.В. Самсонова