Тренировка с ограничением кровотока (KAATSU) и активация клеток-сателлитов
Тренировка с ограничением кровотока (KAATSU), выполняемая с небольшими отягощениями, вызывают активацию и деление клеток-сателлитов в скелетных мышцах человека, что приводит к увеличению ядер в мышечных волокнах и значительной гипертрофии мышц, наблюдаемой при тренировке этого типа. Сигналами, вызывающими повышенную активность клеток-сателлитов при гипертрофической силовой тренировке могут быть: увеличение внутримышечного производства инсулиноподобного фактора роста, а также локальных значений NO; а также уменьшение активности миостатина и других регулирующих факторов.
Aagaard P. Hyperactivation of myogenic satellite cells with blood flow restricted exercise // 8th International Conference on Strength Training, 2012 Oslo, Norway, Norwegian School of Sport Sciences. – P.29-32.
П. Аагаард
ГИПЕРАКТИВАЦИЯ МИОГЕННЫХ КЛЕТОК-САТЕЛЛИТОВ С ПОМОЩЬЮ СИЛОВЫХ УПРАЖНЕНИЙ С ОГРАНИЧЕНИЕМ КРОВОТОКА КРОВИ
Institute of Sports Science and Clinical Biomechanics, University of Southern Denmark, Odense, Denmark
Введение
Упражнения с ограничением потока крови (BFRE)
Силовые упражнения с ограничением потока крови при низкой и средней интенсивной нагрузке (20–50% от максимума) с использованием параллельного ограничения потока крови (гипоксическая силовая тренировка) вызывает нарастающий интерес как в научных, так и прикладных областях (Manini & Clarck 2009, Wernbom et al. 2008). Растущая популярность обусловлена тем, что масса скелетных мышц и максимальная мышечная сила могут быть увеличены в такой же или большей степени с помощью гипоксической силовой тренировки (Wernbom et al., 2008) по сравнению с обычными силовыми тренировками с большими отягощениями (Aagaard et al., 2001). Кроме того, гипоксическая силовая тренировка, по-видимому, приводит к усиленным гипертрофическим ответам и приросту силы, по сравнению с упражнениями, применяющими идентичную нагрузку и объем без перекрытия кровотока (Abe et al. 2006, Holm et al. 2008), хотя потенциальная гипертрофическая роль низко интенсивных силовых тренировок может также существовать сама по себе (Mitchell et al. 2012). Тем не менее, конкретные механизмы, отвечающие за адаптивные изменения в сморфологии скелетных мышц при гипоксической силовой тренировке остаются практически неизвестными. Синтез белков миофибрилл увеличивается при интенсивных сессиях гипоксической силовой тренировки вместе с нерегулируемой деятельностью в AKT/mTOR путях (Fujita et al. 2007, Fry et al. 2010). Кроме того, уменьшение экспрессии генов, вызывающих протеолиз (FOXO3a, Atrogin, MuRF-1) и миостатина, отрицательного регулятора мышечной массы наблюдались после интенсивной гипоксической силовой тренировки (Manini et al. 2011, Laurentino et al. 2012).
Миогенные клетки-сателлиты
Клетки-сателлиты являются недифференцированными миогенными клетками-предшественниками, способными повторно делиться для создания новых мышечных волокон и/или предоставления новых миоядер в существующие мышечные волокна во время постнатального роста (Kadi et al. 2005, Hawke & Garry 2001, Boldrin et al. 2010). В скелетных мышцах клетки-сателлиты расположены между базальной мембранной и сарколеммой мышечного волокна (Kadi et al. 2005, Pallafacchina et al. 2012). Представляется, что силовая тренировка вызывает активацию клеток-сателлитов в скелетных мышцах человека как у молодых, так и у взрослых индивидов (Zammit et al. 2006, Mackey et al. 2007, Kadi & Ponsot 2010) в зависимости от величины нагрузки (Hanssen et al. 2012). Активация и распространение миогенных клеток-сателлитов ассоциируется с ускоренными и увеличенными гипертрофированными ответами на силовую тренировку (Petrella et al. 2008, Olsen et al. 2006), а количество миоядер в мышечном волокне влияет на ограничительный эффект масштаба гипертрофии мышечного волокна (Kadi et al. 2004, Petrella et al. 2008). Индуцированное силовыми упражнениями увеличение количества миоядер происходит в основном в высоко гипертрофированных мышечных волокнах (Kadi & Thornell 2000, Kadi et al. 2004, Olsen et al. 2006, Petrella et al. 2008, Mackey et al. 2010). Это говорит о том, что активация клеток-сателлитов играет существенную роль в условиях усиленного синтеза белка мышц путем увеличения транскрипционной способности мышечных волокон. Однако до недавнего времени оставался неизученным эффект гипоксической силовой тренировки на миогенную активацию клеток-сателлитов и увеличение количества миоядер.
Влияние гипоксической силовой тренировки на сократительные функции мышц
При гипоксической силовой тренировке с низкой и умеренной тренировочной нагрузкой отмечался значительный рост максимальной мышечной силы (МVC), несмотря на относительно короткие периоды тренировок (4-6 недель) (например, Takarada et al. 2002, Kubo et al. 2006; обзор Wernbom et al. 2008). В частности, адаптивный эффект гипоксической силовой тренировки на сократительную функцию мышц (МVC и мощность) сопоставим с достигаемой с помощью силовых тренировок с большими отягощениями в течение 12-16 недель (Wernbom et al. 2008). Однако, влияние гипоксической силовой тренировки на способность скелетной мышцы быстро сокращаться (RFD) остается в значительной степени неизученным, к этому явлению интерес стал проявляться интерес совсем недавно (Nielsen et al., 2012).
Влияние гипоксической силовой тренировки на размер мышечного волокна
При гипоксической силовой тренировке с использованием интенсивной нагрузки с небольшими отягощениями был выявлен значительный прирост объема мышечного волокна и поперечного сечения (CSA) всей мышцы (Abe et al. 2006, Ohta et al. 2003, Kubo et al. 2006, Takadara et al. 2002). Наоборот, тренировки с небольшими отягощениями без ишемии обычно приводят к отсутствию результата (Abe et al. 2006, Mackey et al. 2010) или небольшому увеличению (<5%) (Holm et al. 2008) роста мышечного волокна, хотя это недавно было оспорено (Mitchell et al. 2012). При гипоксической силовой тренировке большой прирост в объеме мышечного волокна частично объясняется распространением миогенных клеток-сателлитов и формированием новых миоядер.
Влияние гипоксической силовой тренировки на миогенные клетки-сателлиты и количество миоядер
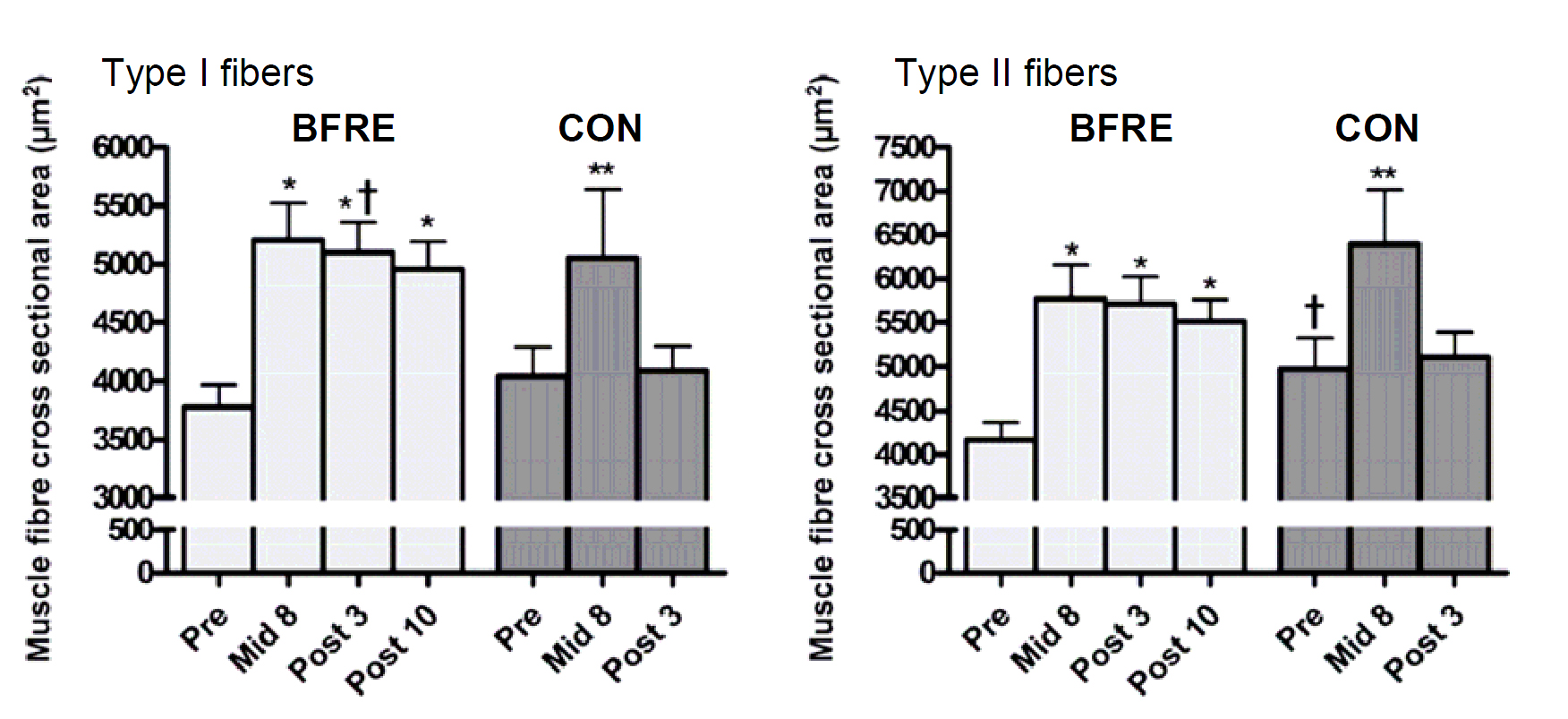
Мы недавно исследовали вовлечение миогенных клеток-сателлитов в увеличение миоядер в ответ на гипоксическую силовую тренировку (Nielsen et al. 2012). Были обнаружены доказательства распространения клеток-сателлитов и увеличение количества миоядер при через 3 недели после гипоксической силовой тренировки, что сопровождалось значительным увеличением объема мышечного волокна (Nielsen et al. 2012). (Рис.1).
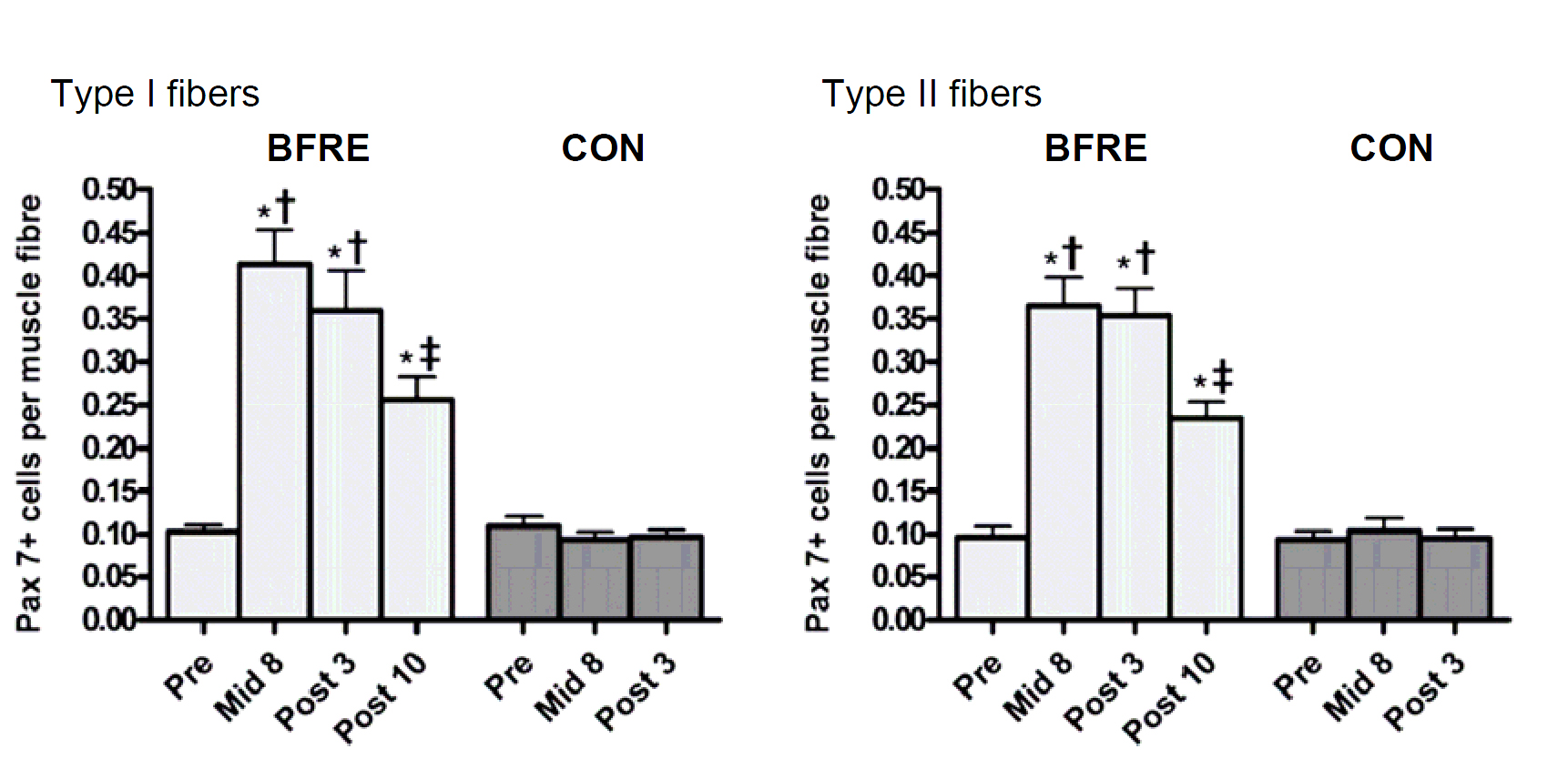
Плотность и количество Рах-7+ клеток-сателлитов увеличилось в 1-2 раза (то есть на 100-200%) после 19 дней гипоксической силовой тренировки (рис. 2). Это значительно превышает 20-40% увеличение количества клеток-сателлитов, наблюдаемое после нескольких месяцев традиционных силовых тренировок (Kadi et al. 2005, Olsen et al. 2006, Mackey et al. 2007). Количество и плотность клеток-сателлитов увеличились одинаково в мышечных волокнах типа I и II (Nielsen et al. 2012) (Рис.2). В то время как при обычных силовых тренировках с большими отягощениями больший ответ наблюдается в клетках-сателлитах мышечных волокон II типа по сравнению с типом I, (Verdijk et al. 2009). Кроме того, при гипоксической силовой тренировке значительно увеличилось количество миоядер (+ 22-33%), в то время как миоядерный домен (объем мышечного волокна /количество миоядер) остался без изменений (~1800-2100 мкм2), хотя наблюдалось легкое, пусть даже и временное, уменьшение на восьмой день тренировки (Nielsen et al. 2012).
Последствия роста мышечного волокна
Рост активности клеток-сателлитов, вызванный гипоксической силовой тренировкой (Рис. 2), сопровождался значительной гипертрофией мышечного волокна (+30-40%) в мышечных волокнах I и II из биопсий, взятых 3-10 дней спустя после тренировки (Рис. 1). В дополнение гипоксическая силовая тренировка вызвала значительное увеличение максимального произвольного сокращения мышц (MVC ~10%) и RFD (16-21%) (Nielsen и др., ICST 2012).
После гипоксической силовой тренировки увеличение количества клеток-сателлитов положительно влияет на рост мышечного волокна. Наблюдались положительная корреляция между изменениями до и после тренировок среднего значения площади поперечного сечения мышечного волокна и прироста количества клеток-сателлитов и числа миоядер соответственно (r=0.51-0.58, p<0.01).
Никаких изменений в перечисленных выше параметрах не было обнаружено в контрольной группе, выполнявшей схожий тип тренировки без ограничения потока крови, за исключением временного увеличения размера мышечных волокон типов I+II через восемь дней тренировок.
Потенциальные адаптивные механизмы
Было обнаружено, что CSA мышечных волокон увеличивается у обоих типов волокон только через восемь дней гипоксической силовой тренировки (10 тренировочных сессий) и сохраняется повышенным на третий и десятый дней после тренировки (Nielsen et al., 2012). Неожиданно, CSA мышц также временно увеличились у исследуемых контрольной группы, выполняющих неокклюзионные тренировки на восьмой день, но вернулись к базовому уровню после 19 дней тренировки. Эти наблюдения предполагают, что быстрое начальное изменения в CSA мышечных волокон зависит от факторов, отличных от накопления миофибриллярных белков, таких как отек мышечных волокон.
Краткосрочный отек мышечных волокон может быть вызван изменением каналов сарколеммы, вызванной гипоксией (Korthuis и др. 1985), открытием мембранных каналов, которое обусловлено растяжением (Singh & Dhalla 2010) или микрофокальным повреждением самой сарколеммы (Grembowicz и др. 1999). Напротив, более поздний прирост CSA мышечного волокна наблюдавшийся после 19 дней гипоксической силовой тренировки (Рис. 1), вероятно, обусловлен аккумуляцией миофибриллярных белков, так как CSA мышечного волокна сохранялось повышенным 3-10 дней после тренировки наряду с 7-11% сохраняемым подъемом максимального произвольного сокращения мышц (MVC) и RFD.
Специфичные пути стимулированного действия гипоксической силовой тренировки на миогенные клетки-сателлиты остаются неисследованными. Гипотетически, снижение количества выделения миостатина после гипоксической силовой тренировки (Manini и др. 2011, Laurentino et al., 2012) может играть важную роль, так как миостатин – сильный ингибитор активации миогенных клеток-сателлитов (McCroskery и др. 2003, McKayи др. 2012) путем подавления сигналов Pax-7 (McFarlane et al. 2008). Введение вариантов соединений инсулиноподобного фактора роста (IFR): IFR-1Еа и IFR-1Еb (механозависимый фактор роста) после гипоксической силовой тренировки может потенциально также играть важную роль, так как известно, что они являются сильными стимулами распространения и дифференциации клеток-сателлитов (Hawke & Garry 2001, Boldrin и др. 2010). Механический стресс, воздействующий на мышечные волокна может запустить активацию клеток-сателлитов через выпуск окиси азота (NO) и фактора роста гепатоцитов (HGR) (Tatsumi и др. 2006, Punch и др. 2009). Следовательно, NO также может быть важным фактором для гиперактивации миогенных клеток-сателлитов, наблюдаемой при гипоксической силовой тренировке, так как временные подъемы значений NO могут, вероятно, случаться в результате ишемических условий при гипоксической силовой тренировке.
Дальнейшую дискуссию потенциальных сигнальных путей, которые могут активировать миогенные клетки-сателлиты при гипоксической силовой тренировке, см. в презентации конференции Wernborn (ICST 2012).
Заключение
Краткосрочные силовые упражнения, выполняемые с небольшими отягощениями и частичным ограничением потока крови, по-видимому, вызывают значительную пролиферацию миогенных стволовых клеток-сателлитов и приводит к увеличению миоядер в скелетных мышцах человека, которое вносит вклад в ускорение и значительную степень гипертрофии мышечных волокон, наблюдаемую при тренировке этого типа. Молекулярными сигналами, вызывающими повышенную активность клеток-сателлитов при гипертрофической силовой тренировке могут быть: увеличение внутримышечного производства инсулиноподобного фактора роста, а также локальных значений NO; а также уменьшение активности миостатина и других регулирующих факторов.
Литература
1) Aagaard P Andersen JL, Dyhre-Poulsen P, Leffers AM, Wagner A, Magnusson SP, Halkjaer-Kristensen J, Simonsen EB. J. Physiol. 534.2, 613-623, 2001
2) Abe T, Kearns CF, Sato Y. J. Appl. Physiol. 100, 1460-1466, 2006 Boldrin L, Muntoni F, Morgan JE., J. Histochem. Cytochem. 58, 941–955, 2010
3) Fry CS, Glynn EL, Drummond MJ, Timmerman KL, Fujita S, Abe T, Dhanani S, Volpi E, Rasmussen BB. J. Appl. Physiol. 108, 1199–1209, 2010
4) Fujita S, Abe T, Drummond MJ, Cadenas JG, Dreyer HC, Sato Y, Volpi E, Rasmussen BB. J. Appl. Physiol. 103, 903–910, 2007
5) Grembowicz KP, Sprague D, McNeil PL. Mol. Biol. Cell 10, 1247–1257, 1999
6) Hanssen KE, Kvamme NH, Nilsen TS, Rønnestad B, Ambjørnsen IK, Norheim F, Kadi F, Hallèn J, Drevon CA, Raastad T. Scand. J. Med. Sci. Sports, in press 2012
7) Hawke TJ, Garry DJ. J. Appl. Physiol. 91, 534–551, 2001
8) Holm L, Reitelseder S, Pedersen TG, Doessing S, Petersen SG, Flyvbjerg A, Andersen JL, Aagaard P, Kjaer M. J. Appl. Physiol. 105, 1454–1461, 2008
9) Kadi F, Charifi N, Denis C, Lexell J, Andersen JL, Schjerling P, Olsen S, Kjaer M. Pflugers Arch. — Eur. J. Physiol. 451, 319–327, 2005
10) Kadi F, Ponsot E. Scand. J. Med. Sci.Sports 20, 39–48, 2010
11) Kadi F, Schjerling P, Andersen LL, Charifi N, Madsen JL, Christensen LR, Andersen JL. J. Physiol. 558, 1005–1012, 2004
12) Kadi F, Thornell LE. Histochem. Cell Biol. 113, 99–103, 2000 Korthuis RJ, Granger DN, Townsley MI, Taylor AE. Circ. Res. 57, 599–609, 1985
13) Kubo K, Komuro T, Ishiguro N, Tsunoda N, Sato Y, Ishii N, Kanehisa H, Fukunaga T, J. Appl. Biomech. 22,112–119, 2006
14) Laurentino GC, Ugrinowitsch C, Roschel H, Aoki MS, Soares AG, Neves M Jr, Aihara AY, Fernandes Ada R,Tricoli V. Med. Sci. Sports Exerc. 44, 406–412, 2012
15) Mackey AL, Esmarck B, Kadi F, Koskinen SO, Kongsgaard M, Sylvestersen A, Hansen JJ, Larsen G, Kjaer M. Scand. J. Med. Sci. Sports 17, 34–42, 2007
16) Mackey AL, Holm L, Reitelseder S, Pedersen TG, Doessing S, Kadi F, Kjaer M. Scand. J. Med. Sci. Sports 21, 773–782б 2010
17) Manini TM, Clarck BC. Exerc. Sport Sci. Rev. 37, 78-85, 2009
18) Manini TM, Vincent KR, Leeuwenburgh CL, Lees HA, Kavazis AN, Borst SE, Clark BC. Acta Physiol. (Oxf.) 201, 255– 263, 2011
19) McCroskery S, Thomas M, Maxwell L, Sharma M, Kambadur R. J. Cell Biol. 162, 1135–1147, 2003
20) McFarlane C, Hennebry A, Thomas M, Plummer E, Ling N, Sharma M, Kambadur R. Exp. Cell Res. 314, 317–329, 2008
21) McKay BR, Ogborn DI, Bellamy LM, Tarnopolsky MA, Parise G. FASEB J. 26, 2509–2521, 2012
22) Mitchell CJ, Churchward-Venne TA, West DW, Burd NA, Breen L, Baker SK, Phillips SM, J. Appl. Physiol. 113, 71–77, 2012
23) Nielsen JL, Aagaard P, Bech RD, Nygaard T, Hvid LG, Wernbom M, Suetta C, Frandsen U. J. Physiol. 590.17, 4351–4361, 2012
24) Nielsen JL, Frandsen F, Hvid LG, Aagaard P. Proc. Int. Conf. Strength Train. (ICST 2012), Oslo, 2012
25) Ohta H, Kurosawa H, Ikeda H, Iwase Y, Satou N, Nakamura S. Acta Orthop. Scand. 74, 62-68, 2003
26) Olsen S, Aagaard P, Kadi F, Tufekovic G, Verney J, Olesen JL, Suetta C, Kjaer M. J. Physiol. 573, 525–534, 2006
27) Pallafacchina G, Blaauw B, Schiaffino S. Nutr. Metab. Cardiovasc. Dis., in press 2012
28) Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM. J. Appl. Physiol. 104, 1736–1742, 2008
29) Punch VG, Jones AE, Rudnicki MA. WIREs Syst. Biol. Med. 1, 128–140, 2009
30) Singh RB, Dhalla NS. Can. J. Physiol. Pharmacol. 88, 388–397, 2010
31) Takarada Y, Sato Y, Ishii N. Eur. J. Appl. Physiol. 86, 308–314, 2002
32) Takarada Y, Takazawa H, Sato Y, Takebayashi S, Tanaka Y, Ishii N. J. Appl. Physiol. 88, 2097–2106, 2000
33) Tatsumi R, Liu X, Pulido A, Morales M, Sakata T, Dial S, Hattori A, Ikeuchi Y, Allen RE. Am. J. Physiol. Cell Physiol. 290, C1487–1494, 2006
34) Verdijk LB, Gleeson BG, Jonkers RA, Meijer K, Savelberg HH, Dendale P, van Loon LJ. J. Gerontol. A Biol.Sci. Med. Sci. 64A, 332–339, 2009
35) Wernbom M, Augustsson J, Raastad T. Scand. J. Med. Sci. Sports 18, 401-416, 2008
36) Wernbom M. Proc. Int. Conf. Strength Train. (ICST 2012), Oslo 2012
37) Zammit PS, Partridge TA, Yablonka-Reuveni Z. J. Histochem. Cytochem. 54, 1177-1191, 2006
Благодарности Выражаю благодарность коллегам: Jakob L. Nielsen, Rune Dueholm Bech, Tobias Nygaard, Lars Grøndahl Hvid, Mathias Wernbom, Charlotte Suetta, Ulrik Frandsen.
Перевод – Токмакова Е.П.
Редакция – Самсонова А.В.