Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Миоглобин скелетных мышц
Определение
Миоглобин (Mb) – белок, который связывает кислород в скелетных мышцах и миокарде (сердечной мышце) почти всех млекопитающих, в том числе и человека. Молекулярная масса миоглобина – 17,2 кДа (1Да=1,66 10-24 г.).
Структура миоглобина
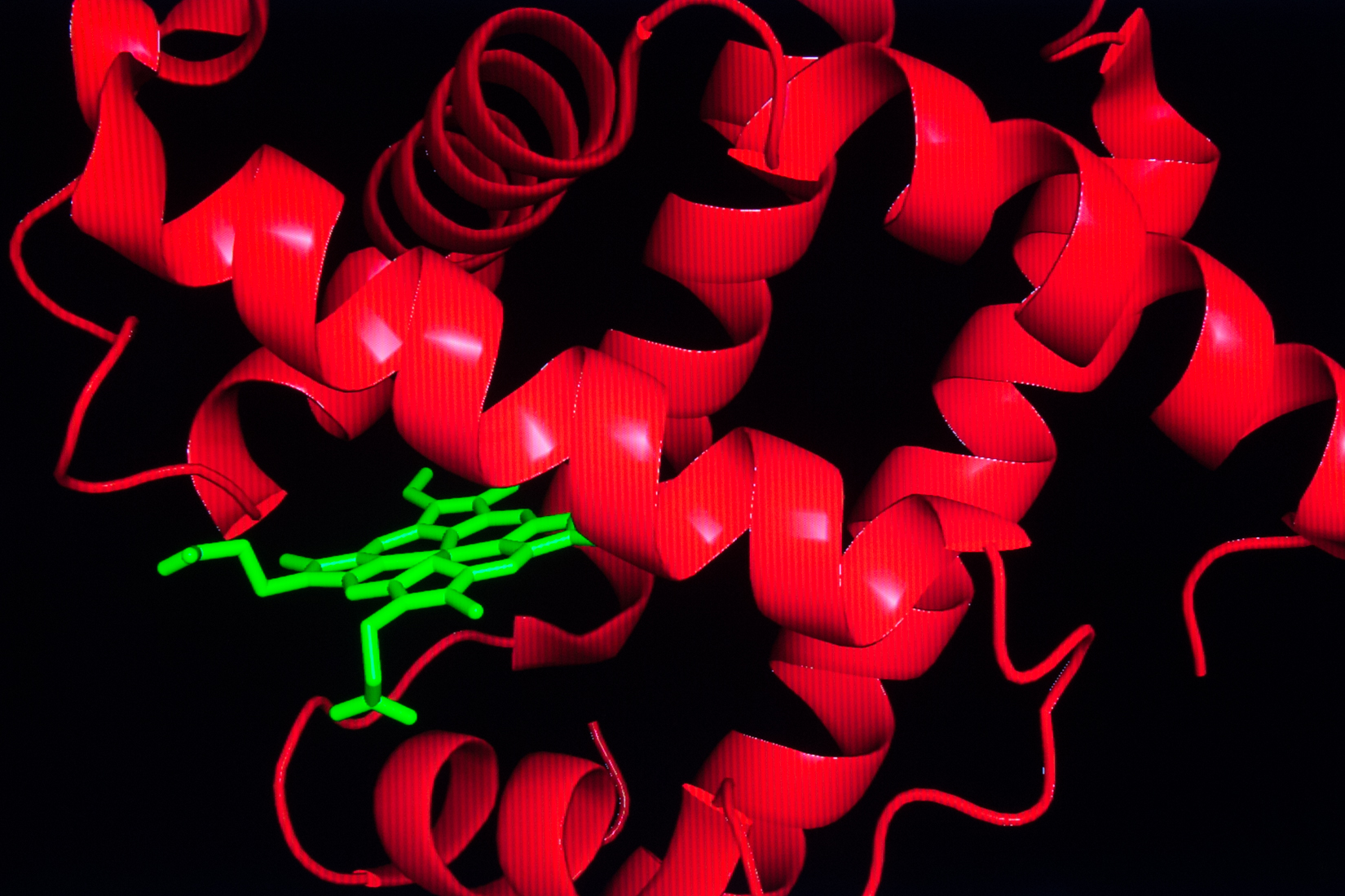
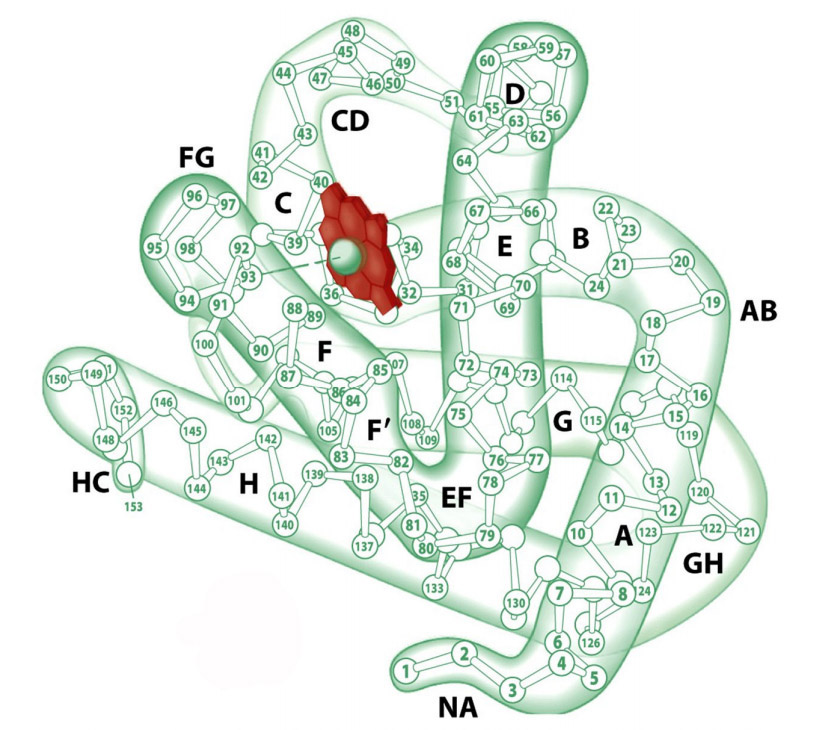
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью – гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
- Депонирует кислород. Мышцы, поглощая кислород из крови, накапливают его в мышечных волокнах в вида оксимиоглобина. Таким образом создается резерв миоглобина, который используется для усиления окислительных процессов при тяжелой физической работе. Депонирование происходит в период покоя, расход в момент сокращения мышц. Однако емкость этого депо невелика. Оно может обеспечить снабжение кислородом скелетные мышцы в течение 8 с, а миокард в течение 15-20 с (Стародуб Р.Ф., Коробов В.Н., Назаренко В.И., 1992).
- Переносит кислород от плазматической мембраны к митохондриям. Тем самым обеспечивая функционирование тканевого дыхания.
- Связывает и освобождает оксид азота (NO) – одну из главных сигнальных молекул, играющих критическую роль в контроле поглощения кислорода, вазодилятации (расширения) сосудов и защиты мышечных волокон от активных форм кислорода (Кулева Н.В., Красовская И.Е., 2016).
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) – кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин – депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина – из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.
Литература
- Кулева Н.В., Красовская И.Е. Новая роль миоглобина в функционировании сердечной и скелетной мышц // Молекулярная биофизика, 2016.– Т. 61., Вып. 5.– С. 861-864.
- Стародуб Р.Ф., Коробов В.Н., Назаренко В.И. Миоглобин: структура, свойства, синтез и биологическая роль.– Киев: Наукова думка, 1992.– 281 с.
- Терентьев А.В. Биохимия мышечной ткани: Учебное пособие.– М.: ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, 2019.– 2019 с.
С уважением, А.В. Самсонова