Типы мышечных волокон и методы их классификации
В статье на основе анализа литературных источников описаны различные классификации мышечных волокон: на основе оценки активности АТФ-азы миозина, митохондриальных ферментов, изоформ тяжелых цепей миозина (MHC) и антител. Приводятся результаты классификации мышечных волокон различными методами.

Самсонова А.В., Самсонов М.А., Самсонов Г.А. Типы волокон скелетных мышц человека и методы их классификации // Труды кафедры биомеханики университета имени П.Ф.Лесгафта, 2023.- Вып.17.- С.35-45.
УДК 612.746+796
Самсонова А.В., Самсонов Г.А., Самсонов М.А.
ТИПЫ ВОЛОКОН СКЕЛЕТНЫХ МЫШЦ ЧЕЛОВЕКА И МЕТОДЫ ИХ КЛАССИФИКАЦИИ
Аннотация
В статье на основе анализа литературных источников описаны различные классификации мышечных волокон: на основе оценки активности АТФ-азы миозина, митохондриальных ферментов, изоформ тяжелых цепей миозина (MHC) и антител. Приводятся результаты классификации мышечных волокон различными методами. В большинстве случаев разные классификации дают сходные результаты, однако мышечные волокна в пределах каждой классификации проявляют химические и механические свойства, несколько отличные от свойств мышечных волокон, используемых в других классификациях.
Ключевые слова
Cкелетные мышцы, типы мышечных волокон, классификации мышечных волокон
Samsonova A.V., Samsonov G.A., Samsonov M.A.
TYPES OF HUMAN SKELETAL MUSCLE FIBERS AND CLASSIFICATION METHODS
Abstract
Based on the analysis of literature sources, the article describes different classifications of muscle fibers: based on the assessment of myosin ATP-ase activity, mitochondrial enzymes, myosin heavy chain (MHC) isoforms and antibodies. The results of muscle fiber classification by different methods are presented. In most cases, the different classifications yield similar results, but muscle fibers within each classification exhibit chemical and mechanical properties somewhat different from those of muscle fibers used in other classifications.
Keywords
Skeletal muscles, types of muscle fibers, classifications of muscle fibers
Введение
В настоящее время активно изучаются вопросы, связанные c композицией волокон в скелетных мышцах человека и животных. С этой целью применяются различные методы их классификации. Особенно важны эти исследования в области физической культуры и спорта, так как знание композиции мышечных волокон влияет на отбор спортсменов в тот или иной вид спорта, а также позволяет подбирать средства и методы тренировки с учетом его индивидуальных особенностей [1]. В связи с этим, возникает проблема выбора метода для оценки композиции волокон в скелетных мышцах человека.
ЦЕЛЬЮ настоящей статьи является описание методов классификации мышечных волокон человека и животных, используемых на ранних этапах изучения мышечной деятельности и в настоящее время.
Результаты
Первые классификации мышечных волокон
Одним из первых на различие мышц у животных обратил внимание Стефано Лоренцини в 1678 году [12]. Он установил, что у кролика скелетные мышцы различаются по цвету. Французский гистолог Луи Ранвье [20] посредством экспериментов доказал, что мышцы животных различаются друг от друга не только по цвету, но и по скорости сокращения. Он установил, что одни мышцы сокращаются медленнее, чем другие и имеют более явный красный цвет. Таким образом, первая классификация была основана на внешнем виде мышцы. После этого стали разрабатываться классификации мышечных волокон животных и человека, основанные на различных классификационных признаках.
Классификация мышечных волокон на основе оценки активности АТФ-азы миозина
Вначале была разработана классификация мышечных волокон на основе активности АТФ-азы миозина[1] [17], идея которой состояла в следующем. Вначале проводилась биопсия мышцы [4]. С этой целью в мышцу вводилась полая игла и с помощью плунжера внутри иглы отрезался небольшой фрагмент мышцы (80–160 мг). Его очищали от крови и замораживали. После этого фрагмент мышцы разрезался на тонкие слои толщиной 10 мкм и исследовался под микроскопом.
После процедуры биопсии кусочки мышечной ткани выдерживали в щелочной среде (рН[2]=9,4). Было установлено, что медленные мышечные волокна в щелочной среде приобретают светлую окраску. Это связано с тем, что фермент АТФ-аза «медленного» миозина к этой среде неустойчива, поэтому медленные волокна в щелочной среде светлеют и теряют свою активность. Наоборот, АТФ-аза «быстрого» миозина устойчива к щелочной среде. Поэтому быстрые мышечные волокна в щелочной среде сохраняют свою активность и цвет. В результате были выделены два типа мышечных волокон: медленносокращающиеся: тип I (ST – slow twitch) и быстросокращающиеся – тип II (FT – fast twitch), рис.1.
Затем в начале 70-х годов XX века М.Н. Brook и К.К. Kaiser [5] несколько изменили методику H. A. Padykula и E. Herman [17], позволяющую классифицировать мышечные волокна на основе оценки степени активности фермента АТФ-азы, и предложили выделять четыре типа мышечных волокон: тип I, тип IIA тип IIB и тип IIC. В связи с тем, что в скелетных мышцах выделяют не более 3% мышечных волокон типа IIC [21], наибольшее распространение получило выделение трех типов мышечных волокон: тип I, тип IIA и тип IIB.
![Типы мышечных волокон в четырехглавой мышце (m. quadriceps femoris) человека. Классификация по степени активности фермента миозин АТФ-азы. Преинкубация при pH=10,4 [27]](https://allasamsonova.ru/wp-content/uploads/ris_4_2_st-i-ft.jpg)
Преинкубация в щелочной среде (рН=10,3-10,4)
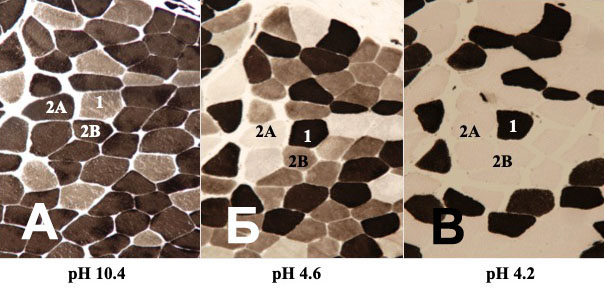
После процедуры выдерживания в щелочной среде (рН=10,3-10,4) быстрые мышечные волокна (тип IIA и тип IIB) приобретают темную окраску, а медленные становятся светлыми (рис.2А). Это позволяет разделить мышечные волокна, как указывалось выше, на два типа: тип I и тип II.
Преинкубация в кислой среде (рН=4,6)
После выдерживания препаратов в кислой среде (рН=4,6) мышечные волокна, содержащие различные типы миозина, приобретают разную окраску. Медленные мышечные волокна окрашиваются в темный цвет, промежуточные мышечные волокна (тип IIA) отличаются менее интенсивным окрашиванием, в то время как волокна типа IIB не окрашиваются вовсе, то есть становятся светлыми (рис.2Б). После процедуры преинкубации становится возможным классификация мышечных волокон, подсчет количества мышечных волокон различных типов и определение композиции волокон в скелетной мышце.
Преинкубация в кислой среде (рН=4,2)
После выдерживание препарата в кислой среде (рН=4,2) АТФ-аза миозина, содержащегося в медленных мышечных волокнах, не теряет свой цвет и активность. АТФ-аза миозина, содержащегося в быстрых мышечных волокнах, в кислой среде инактивируется. Поэтому медленные мышечные волокна приобретают темную окраску, а быстрые – светлую. Это также позволяет разделить мышечные волокна, как указывалось выше на два типа: тип I и тип II (рис.2В).
Классификация мышечных волокон на основе оценки активности митохондриальных ферментов
После разработки классификации мышечных волокон на основе АТФ-азы миозина было предложено [25; 8] классифицировать мышечные волокна по степени активности митохондриальных ферментов, в частности на основе фермента сукцинатдегидрогеназы (СДГ). На основе этой классификации мышечные волокна были разделены на медленносокращающиеся окислительные мышечные волокна (SO – Slow-twitch Oxidative), быстросокращающиеся окислительно-гликолитические мышечные волокна (FOG – Fast-twitch Oxidative-Glycolytic), быстросокращающиеся гликолитические мышечные волокна (FG – Fast-twitch Glycolytic), рис.3.
![Типы мышечных волокон в пучке волокон скелетной мышцы человека. Классификация по степени активности фермента сукцинатдегидрогеназы (СДГ) [13]](https://allasamsonova.ru/wp-content/uploads/ris_4_7_so_fog_fg.jpg)
Классификация мышечных волокон на основе оценки изоформ тяжелых цепей миозина (Myosin Heavy Chain isoform – MHC).
Вплоть до начала XXI века в большом количестве исследований использовалась классификация мышечных волокон, основанная на оценке активности АТФ-азы миозина. Однако в настоящее время все больше ученых используют типизацию мышечных волокон, основанную на оценке изоформ[3] тяжелых цепей миозина (Myosin Heavy Chain isoform – MHC).
Классификация мышечных волокон на основе тяжелых цепей миозина проводится на основе электрофореза[4] или иммуногистохимического анализа. Каждый метод имеет свои достоинства и недостатки. Классификация мышечных волокон в основе которой лежит электрофорез белков имеет две разновидности.
В первой разновидности после проведения биопсии выделяют пучок мышечных волокон. После этого он гомогенизируется[5], то есть превращается в однородную массу механическим или химическим путем и подготавливается к электрофорезу. Затем мышечную ткань помещают в полиакриламидный гель и производят электрофорез [10]. Этот метод разделения белков по массе получил название SDS-PAGE по Лэммли. После окрашивания геля для лучшей визуализации при помощи денситометра оценивается плотность белковых пятен (рис.4а).
Считается, что плотность белковых пятен соответствует проценту изоформ тяжелых цепей миозина. То есть, если анализируемый пучок мышечных волокон, содержит ~50% белка MHC типа I, ~40% белка MHC типа IIa, и ~10% MHC типа IIx, исследователь предполагает, что мышца содержит соответствующий процент мышечных волокон типа MHCI, MHCIIa и MHCIIx. Недостатком метода является невозможность выявления «гибридных» мышечных волокон [19].
Во второй разновидности классификации изучается отдельное мышечное волокно. Это позволяет четко обнаруживать «гибридные» волокна (рис.4b). После процедуры биопсии, выделяют мышечные волокна (до 800 штук) и анализируют каждое отдельно. С этой целью каждое мышечное волокно по очереди помещают в полиакриламидный гель и производят электрофорез. В результате этой процедуры изоформы миозина с различной массой концентрируются в различных местах геля. Затем производится окрашивание геля для лучшей визуализации результатов.
![Различные способы оценки композиции мышечных волокон на основе анализа тяжелых цепей миозина [19]](https://allasamsonova.ru/wp-content/uploads/ris_4_8_razlichnye-sposoby-ocenki-kompozicii.jpg)
Тип изоформы мышечного волокна определяют на основе положения белкового пятна на цифровой фотографии. Белковое пятно внизу цифровой фотографии (рис.5, полоски 6-9, 13 и 15) соответствует изоформе МНСI, несколько выше располагается белковое пятно, соответствующее изоформе МНСIIа (полоски 1 и 2), еще выше (полоска 10) – MHCIIв (МНСIIх) (рис. 5). Если на полоске имеется два белковых пятна, как, например, на полосках 3-5, то считается, что мышечное волокно содержит две изоформы тяжелых цепей миозина: MHCIIа и MHCIIв (MHCIIх). То же самое относится к полоске 12. Считается, что мышечное волокно содержит два типа тяжелых цепей миозина: MCHI и MHCIIа.
![Цифровые фотографии распределения изоформ MHC в фрагментах 15 отдельных мышечных волокон четырехглавой мышцы бедра [11]](https://allasamsonova.ru/wp-content/uploads/ris_4_9_chistye-myshechnye-volokna-bukvu-v-pomenjala-na-x-scaled.jpg)
Мышечные волокна, содержащие только одну изоформу MHC, называют «чистыми». Это: MHCI, MHCIIа и MHCIIх (MHCIIв). Существуют также мышечные волокна, содержащие две изоформы тяжелых цепей миозина, например MHC I/IIa; MHCIIa/IIx [23; 6] или три изоформы тяжелых цепей миозина MHC I/IIa/IIx [26]. Такие мышечные волокна называют «гибридными» (рис. 6). Появление «гибридных» мышечных волокон можно объяснить следующим. Известно, что одно мышечное волокно может содержать несколько тысяч миофибрилл. По-видимому, разные миофибриллы в пределах одного мышечного волокна могут содержать разные изоформы MHC.
![Типы мышечных волокон широкой латеральной мышцы бедра (m. vastus lateralis) молодого мужчины, классифицированные посредство антител [22]](https://allasamsonova.ru/wp-content/uploads/ris_4_12_tipy-myshechnyh-volokon-cheloveka-immunogistohimicheskij-analiz.jpg)
Хотя различные классификации мышечных волокон часто приводят к сходным результатам, однако они не одинаковы. Исследование композиции мышечных волокон различными методами (на основе оценки АТФ-азной активности миозина и на основе изоформ МНС) было проведено R.S. Staron et al. [24]. В результате проведенного исследования были получены следующие результаты (табл. 2).
W. Scott, J. Stevens, S.A. Binder-Macleod [23] считают, что существует высокая корреляция между свойствами волокон типа I, MHCI и SO. Однако нет полного соответствия свойств мышечных волокон типа IIA мышечным волокнам, классифицированных на основе тяжелых цепей миозина (MHCIIa) и на основе активности ферментов митохондрий (FOG). Тот же вывод относится к мышечным волокнам типа IIB, типа MHCIIх (MHCIIв) и FG, рис.7.
Таблица 1 — Классификации (название и обозначение) мышечных волокон различных типов
| Автор, год | Классификационный признак | Название и обозначение мышечных волокон | |
| английское | русское | ||
| Padykula H. A., Herman E., 1955 [17] | Степень активности АТФ-азы миозина. Преинкубация[1] в щелочной среде (pH=9,4) | slow twitch (ST, тип I) | Медленносокращающиеся, медленные (МС) |
| fast twitch (FT, тип II) | Быстросокращающиеся, быстрые (БС) | ||
| Wattenburg L.W., Leong J.L., 1960 [25]; Kaplov L.S., Polgar J., 1964 [8] | Степень активности окислительных ферментов (сукцинатдегидрогеназы, СДГ (SDH) или никотинамидадениндинуклеотида – НАД (NADH) | Slow-twitch oxidative, (SO) | Медленносокращающиеся окислительные мышечные волокна (МС) |
| Fast-twitch oxidative-glycolytic (FOG) | Быстросокращающиеся окислительно-гликолитические мышечные волокна (БОГ) | ||
| Fast-twitch glycolytic (FG) | быстросокращающиеся гликолитические мышечные волокна (БГ) | ||
| Brook М.Н. Kaiser К.К, 1970 [5] | Степень активности АТФ-азы миозина. Преинкубация в кислой (рН=4,3 и рН=4,6) и щелочной среде (pH=9,4) | Type I | тип I |
| Type IIa | тип IIA | ||
| Type IIb | тип IIB | ||
| Murach K.A. et al., 1985 [14] Perrie W.T., Bumford S.J., 1986 [18] | На основе изоформ тяжелых цепей миозина (Myosin Heavy Chain isoform) | MHCI | MHCI |
| MHCIIa | MHCIIa | ||
| MHCIIХ | MHCIIx | ||
[1] Преинкубация – выдерживание в определенной среде.
Таблица 2 Композиция мышечных волокон латеральной широкой мышцы бедра молодых мужчин (n=95) и женщин (n=55), полученная различными методами [24]
| Пол | Тип волокна | ||
| Тип I | Тип IIA | Тип IIB | |
| Мужчины | 36,2±11,6 | 41,2±9,4 | 22,6±11,8 |
| Женщины | 44,0±11,6 | 33,6±8,7 | 22,4±10,3 |
| MHCI | MHCIIа | MHCIIх | |
| Мужчины | 33,9±11,4 | 46,3±3,0 | 19,8±11,6 |
| Женщины | 41,0±12,9 | 36,0±9,9 | 23,0±12,1 |
![Соответствие свойств мышечных волокон, определенных на основе различных классификационных признаков друг другу [23], рисунок модифицирован](https://allasamsonova.ru/wp-content/uploads/ris_4_13_klassifikacii-1.png)
Рис.7. Соответствие свойств мышечных волокон, определенных на основе различных классификационных признаков друг другу [23], рисунок модифицирован
Заключение
Таким образом, мышечные волокна в пределах каждой классификации проявляют химические и механические свойства, несколько отличные от свойств мышечных волокон, используемых в других классификациях. Если это не учитывать, можно прийти к неправильным выводам.
Так, например, для занимающихся атлетизмом, очень важен вопрос о возможности изменения типа волокна под влиянием физической нагрузки. Однако уже на основе рассмотренных выше данных можно утверждать, что физическая нагрузка влияет на активность СДГ. Она повышается по мере возрастания уровня мастерства спортсменов, тренирующихся на выносливость [7].
Следовательно, изменение типа волокна в классификации мышечных волокон на основе оценки активности СДГ возможно. Этот вывод подтверждается мнением В.Т. Тураева и В.В Тюпа [3] «…следует различать как минимум две классификации мышечных волокон: наследуемая мышечная композиция по миозиновой АТФ-азе, и приобретаемая – по ферментам митохондрий» С. 120.
Кроме того, даже разновидности одного и того же метода (оценка на основе анализа МНС) могут давать различные результаты. Поэтому необходимо обращать внимание, на основе какой классификации делаются выводы в конкретном исследовании.
Литература
- Самсонова А.В., Барникова И.Э., Борисевич М.А., Вахнин А.В. Методы оценки композиции мышечных волокон в скелетных мышцах человека // Труды кафедры биомеханики НГУ им. П.Ф. Лесгафта, 2012.- СПб. – Вып. 6.– С. 18-27.
- Сонькин В.Д., Тамбовцева Р.В. Развитие мышечной энергетики и работоспособности в онтогенезе. М.: Книжный дом «Либроком», 2011. – 368 с.
- Тураев В.Т., Тюпа В.В. Мышечно-сухожильный комплекс: анатомия, биомеханика, спортивная практика. Монография. М: ТВТ Дивизион, 2023. – 320 с.
- Bergström J. Muscle electrolytes in man // Scandinavian Journal of Clinical and Laboratory Investigation, 1962. – Suppl. 68.
- Brooke M.H., Kaiser K.K. Three “myosin ATPase” systems: the nature of their pH lability and sulfhydryl dependence // Journal of Histochemistry & Cytochemistry, 1970. – Vol. 18.– P. 670–672.
- D’Antona G., Lanfranconi F., Pellegrino M.A. [et al.] Skeletal muscle hypertrophy and structure and function of skeletal muscle fibers in male body builders // Journal of Physiology, 2006. – Vol. 570. – No.3. – P. 611-627.
- Gollnick P.D. Armstrong R.B., Saubert IV C.W. [et al.] Enzyme activity and fiber composition in skeletal muscle of untrained and trained men // Journal of Applied Physiology, 1972. – Vol. 33. – No 3. – P. 312-319.
- Kaplov L.S. Polgar J. Cytochemical demonstration of acid phosphatase in hematological disorders using azo dye techniques // Journal of Histochemistry & Cytochemistry, 1964. – Vol. 12. – No 6. – P. 805-810.
- Kupa, E. J., Roy S. H., Kandarian S. C., De Luca C. J. Effects of muscle fiber type and size on EMG median frequency and conduction velocity // Journal of Applied Physiology, 1996. – Vol. 79. – No 1. – P. 23-32.
- Laemmli U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4 // Nature, 1970. – Vol. 227. – P.680 – 685.
- Larsson L., Moss R. L. Maximum Velocity of Shortening in Relation to Myosin Isoform Composition in Single Fibres from Human Skeletal Muscles // Journal of Physiology, 1993. – Vol. 472. – P.595-614.
- Lorenzini S., 1678 Цит. по Denny-Brown D.E The Histological Features of Striped Muscle in Relation to its Functional Activity // Proceedings of the Royal Society of London, 1929. – Vol. 104. – P. 371-411.
- Marieb E.N. Essentials of Human Anatomy & Physiology: Pearson, Edinburg, England, 2015. 1264 p.
- Murach K.A., Dungan C.M., Kosmac K. [et al.] Fiber typing human skeletal muscle with fluorescent immunohistochemistry // Journal Applied Physiology, 1985. Vol. 127. – P. 1632-1639.
- Nilwik R., Snijders T., Leenders M. [et al.] The decline in skeletal muscle mass with aging is mainly attributed to a reduction in type II muscle fiber size // Experimental Gerontology, – Vol.48. – P.492-498.
- Ogata, T., Murata F. Cytological features of three fiber types in human striated Muscle // The Tohoku Journal of Experimental Medicine, 1969. – Vol. 99. – P. 225-245.
- Padykula H. A., Herman The specificity of the histochemical method of adenosine triphosphatase // Journal of Histochemistry & Cytochemistry, 1955. – Vol. 3. – P. 170-195.
- Perrie W.T., Bumford S.J. Electrophoretic separation of myosin isoenzymes. Implications for the histochemical demonstration of fibre types in biopsy specimens of human skeletal muscle // Journal of the Neurological Sciences, 1986. – Vol. 73. – P. 89–96.
- Plotkin D.L., Roberts M.D., Haun C.T., Schoenfeld B.J. Muscle Fiber Type Transitions with Exercise Training: Shifting Perspectives // Sports, 2021. – Vol. 127. – No. 9. – P. 1-11.
- Ranvier L. Propriétés et structures différentes des muiscles rouges et des muscles blancs ches let lapins et chez les raies // C.R. Acad. Sci. Paris, 1873. – Vol. 77. – P. 1030-1034.
- Schantz P., Randall-Fox E., Hutchison W. [et al.] Muscle fibre type distribution, muscle cross-sectional area and maximal voluntary strength in humans // Acta Physiologica Scandinavica, 1983. – Vol. 117. – No 2. – P. 219-226.
- Schiaffino S. Muscle fiber type diversity revealed by anti-myosin heavy chain antibodies // The FEBS Journal, 2018. – Vol. 285. – P. 3688–3694.
- Scott W., Stevens J., Binder-Macleod S.A. Human Skeletal Muscle Fiber Type Classifications Physiology Review, 2001. – Vol. 81. – P.1810-1816.
- Staron R.S., Hagerman F.C., Hikida R.S. [et al.] Fiber Type Composition of the Vastus Lateralis Muscle of Young Men and Women // The Journal of Histochemistry & Cytochemistry, 2000. – Vol. 48. – No.5. – P. 623–629.
- Wattenburg L. W. Leong J.L. Effects of coenzyme Q10 and menadione on succinic dehydrogenase activity as measured by tetrazolium salt reduction // Journal of Histochemistry & Cytochemistry, 1960. – Vol. 8. – P. 296-303.
- Williamson D.L., Gallagher P.M., Carroll C.C. [et al.] Reduction in hybrid single muscle fiber proportions with resistance training in humans // Journal of Applied Physiology, 2001. – Vol. 91. – P.1955–1961.
- Young A. The structure and function of the quadriceps muscle in health and disease, 1982. MD Thesis. – 303 p.
[1] АТФ-аза миозина – фермент, который локализуется на головке миозина и участвует в гидролизе АТФ.
[2] Водородный показатель, рН (от лат. pondus Hydrogenii – вес водорода) – мера кислотности водных растворов. нейтральной среде рН равен 7 (рН=7); в кислой среде меньше 7 (рН <7), в щелочной среде рН больше 7 (рН>7).
[3] Изоформа белка — любая из нескольких разных форм одного и того же белка.
[4] Электрофорез –явление перемещения частиц белковых растворов в жидкой или газообразной среде под действием внешнего электрического поля.
[5] Гомогенизация – технологический процесс, в ходе которого уменьшается степень неоднородности вещества.
[6] Преинкубация – выдерживание в определенной среде.