Состав и строение тонкого филамента
Описан состав и строение тонкого филамента, а также его расположение в структуре саркомера. Функцией тонкого филамента является участие в процессе мышечного сокращения. Дано описание влияния тренировки и невесомости на количество тонких филаментов в саркомере.
Состав и строение тонкого филамента
Характеристика тонкого филамента
Функция тонкого филамента состоит в его участии в процессе сокращения саркомера. В структуре сота толстый филамент окружен с двух сторон шестью тонкими филаментами. Тонкие филаменты прикрепляются к Z-диску. Расстояние между толстым и тонким филаментами составляет около 13 нм. Расстояние между толстыми филаментами в саркомере составляет приблизительно 32,5 нм. Тренировка не влияет на расстояние между толстыми филаментами.
Состав тонкого филамента
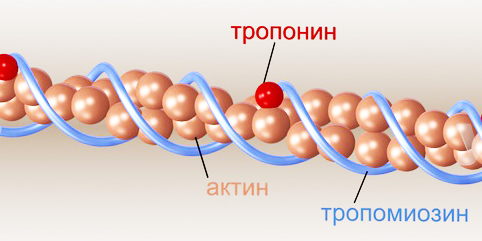
Вначале в составе тонкого филамента был выделен только актин. Поэтому тонкие филаменты назывались актиновыми. Однако затем в составе тонкого филамента были выделены три основных белка: актин, тропомиозин и тропонин.
Актиновые молекулы имеют форму шара (G-актин). Соединяясь друг с другом, они образуют длинные нити (F-актин). Две нити актиновых молекул обвиваются одна относительно другой наподобие бус и формируют основу тонкого филамента. Актиновые молекулы имеют активные центры, способные связываться с молекулами миозина.
Тропомиозин имеет форму трубки. Две скрученные трубки тропомиозина заполняют углубления в актиновых нитях. Название «тропомиозин» связано с тем, что вначале этот белок ошибочно считали предшественником миозина. Однако позже выяснилось, что он выполняет иную функцию – вместе с тропонином он играет ключевую роль в регуляции взаимодействия актина с миозином.
Тропонин прикреплен к нитям актина и тропомиозина через равные промежутки. Эти промежутки составляют 40 нм (рис.1).
Роль белков тонкого филамента в процессе сокращения саркомера
В процессе сокращения саркомера из саркоплазматического ретикулума выделяются ионы кальция. Они взаимодействуют с тропонином. Тропонин изменяет свою конфигурацию и приподнимает тропомиозиновые трубки. На актине открываются активные центры, к которым присоединяются миозиновые головки. После этого начинается процесс, при котором миозиновые головки толстого филамента тянут тонкие филаменты к центру саркомера. В результате этого саркомер сокращается, то есть его длина уменьшается.
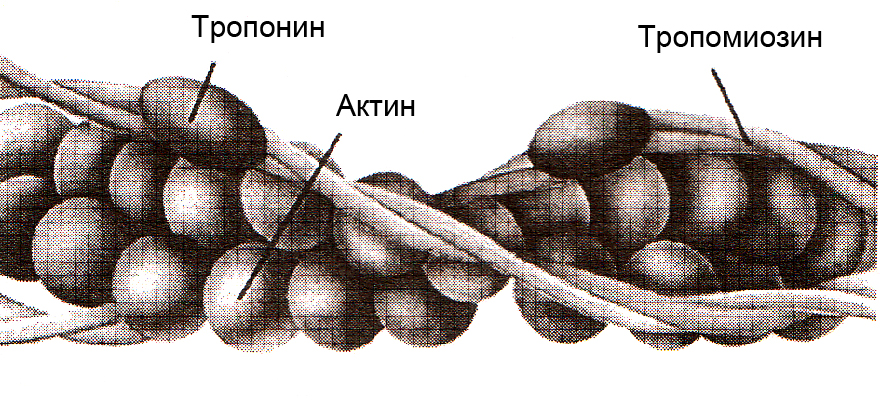
Самосборка тонкого филамента
Установлено, что в растворах с определенной ионной силой происходит самосборка актиновых нитей. При этом молекулы глобулярного актина (G-актин), имеющего шарообразную форму, соединяются в длинные нити, образуя фибриллярный актин (F-актин).
Влияние тренировки
По мере увеличения поперечного сечения в миофибрилле, отношение количества тонких филаментов к толстым уменьшается и стремится к 4. Более подробно это отражено в нашей статье (Г.А. Самсонов, А.В. Самсонова, 2016).
Влияние невесомости
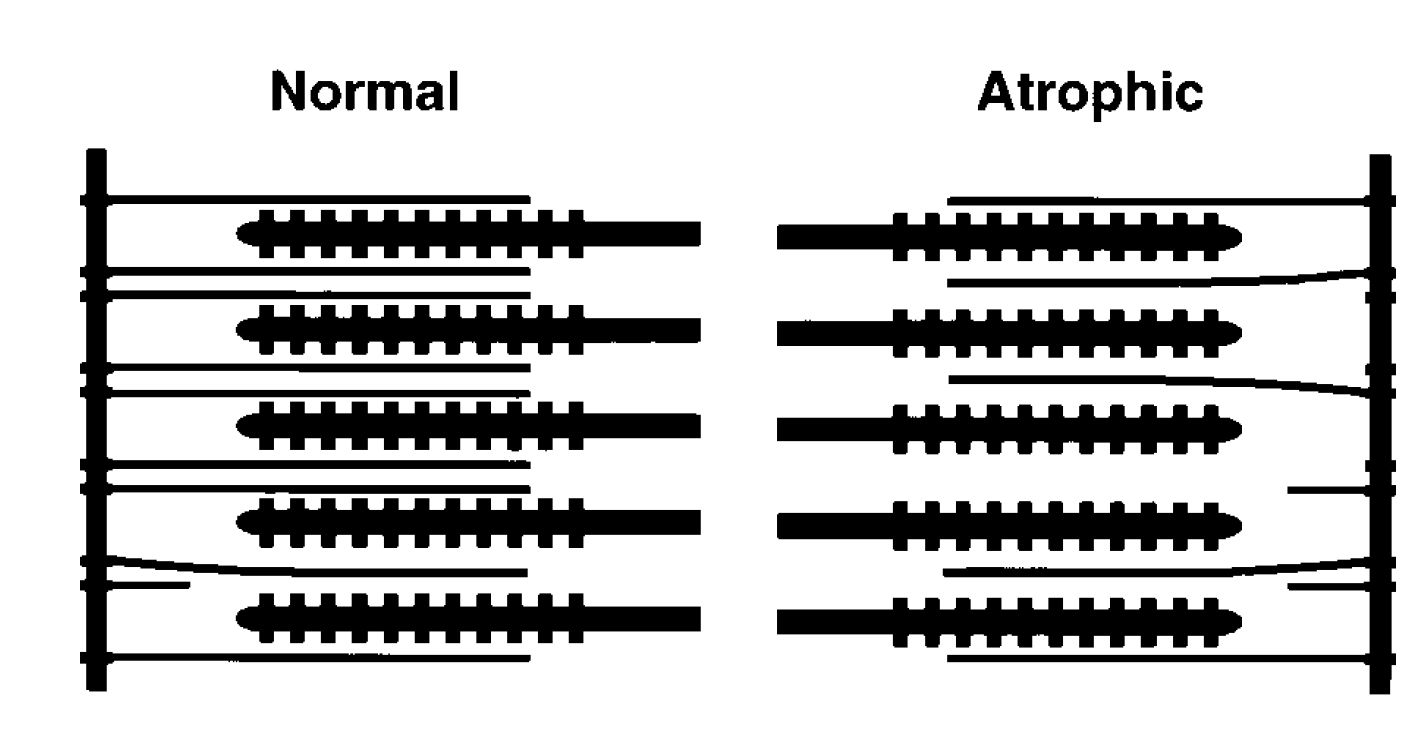
Доказано, что пребывание в течение 17 дней в невесомости во время космического полета привело к уменьшению количества тонких филаментов в саркомере. Количество толстых филаментов в саркомере не изменилось (рис.2).
Литература
- Бендолл Дж. Мышцы, молекулы и движение.- М.: Мир, 1970.- 256 с.
- Самсонов, Г.А. Влияние увеличения площади поперечного сечения саркомера на соотношение тонких и толстых филаментов / Г.А. Самсонов, А.В. Самсонова // Труды кафедры биомеханики университета имени П.Ф.Лесгафта, 2016.- Вып.10.- С. 22-27.
- Самсонова, А.В. Гипертрофия скелетных мышц человека: монография /А.В. Самсонова; Национальный гос. ун-т физ. Культуры, спорта и здоровья им. П.Ф. Лесгафта. – СПб.: [б.и.], 2011.– 203 с. ил.
- Уилмор, Дж. Физиология спорта и двигательной активности / Дж. Уилмор, Д.Л. Костил.– Киев: Олимпийская литература, 1997. – 503 с.
- Riley, D. A. Decreased thin filament density and length in human atrophic soleus muscle fibers after spaceflight /D.A. Riley, J. L. W. Bain, J. L. Thompson, R. H. Fitts, J.J.Widrick, S.W. Trappe, T.A.Trappe, D. L. Costill // J. Appl. Physiol. 88: 567–572, 2000
С уважением, А. В. Самсонова