Состав и строение толстого филамента
Дана характеристика толстого филамента. Описан его состав и строение, а также расположение в структуре саркомера. Главной функцией толстого филамента является участие в процессе мышечного сокращения.
Состав и строение толстого филамента
После того, как мы разобрались из чего состоит саркомер, давайте рассмотрим состав и строение одного из его структурных элементов — толстого филамента. Эти знания необходимы для понимания механизма сокращения скелетных мышц.
Характеристика толстого филамента
Главная функция толстого филамента – участие в процессе сокращения саркомера. Толстый филамент занимает центральное место в структуре сота.
В структуре сота он окружен с двух сторон шестью тонкими филаментами. Расстояние между толстым и тонким филаментами составляет около 13 нм. Расстояние между толстыми филаментами в саркомере составляет приблизительно 32,5 нм. Тренировка не влияет на расстояние между толстыми филаментами.
Состав толстого филамента
Основу толстого филамента составляет белок миозин. Молекула миозина состоит из двух сплетенных протеиновых (белковых) нитей. Один конец этой молекулы называется хвостом. На другом конце эти нити заканчиваются головками, которые называются миозиновыми (рис. 1). Очень часто при описании процесса сокращения саркомера миозиновые головки называются поперечными мостиками.
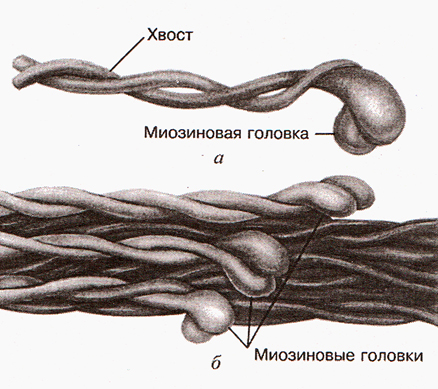
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом.
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Строение толстого филамента
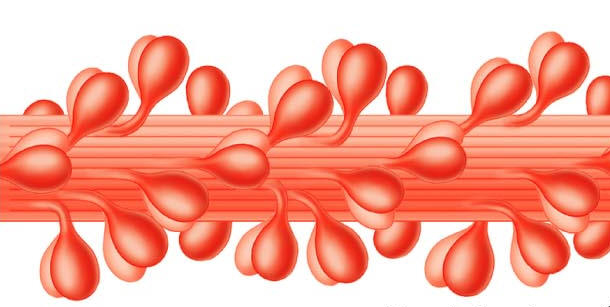
Каждый толстый филамент представляет собой своеобразную структуру, похожую на ствол дерева. Его составляют приблизительно 360 молекул миозина, которые сплетены, как змеи, хвостами и имеют, соответственно, 720 миозиновых головок, расположенных в строгом порядке одна относительно другой (рис. 2).

Эта структура биполярна. В ее середине соединяются (конец в конец) два «ствола». Соединение «стволов» представляет собой М-диск. Головки толстого филамента («кроны» дерева) обращены в разные стороны. Установлено, что «кроны дерева» связаны с Z-диском, разделяющим саркомеры особым белком – титином (тайтином).
Самосборка толстого филамента
Установлено, что в растворах слабой ионной силы молекулы миозина начинают агрегировать (соединяться). В начале хвосты молекул миозина, объединяясь попарно, образуют короткую нить. Головы исходных молекул направлены в противоположные стороны. Затем этот процесс продолжается путем добавления новых молекул миозина. В результате этого формируется толстый филамент.
Литература
- Бендолл Дж. Мышцы, молекулы и движение.- М.: Мир, 1970.- 256 с.
- Самсонова, А.В. Гипертрофия скелетных мышц человека: монография /А.В. Самсонова; Национальный гос. ун-т физ. Культуры, спорта и здоровья им. П.Ф. Лесгафта. – СПб.: [б.и.], 2011.– 203 с. ил.
- Самсонова, А.В. Сот — структурная единица саркомера // А.В. Самсонова, Г.А. Самсонов // Труды кафедры биомеханики университета имени П.Ф.Лесгафта, 2016.- Вып.10.- С. 16-21.
- Уилмор, Дж. Физиология спорта и двигательной активности / Дж. Уилмор, Д.Л. Костил.– Киев: Олимпийская литература, 1997. – 503 с.
С уважением, А. В. Самсонова