Миозин в мышечных волокнах
Дана характеристика молекулы миозина: длина, толщина и молекулярная масса. Описана также структура молекулы миозина: головок и хвоста. Подробно описано формирование толстого филамента путем самосборки и факторы, отрицательно влияющие на этот процесс.
Миозин в мышечных волокнах
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина – 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две – легкие 20 и 17 кДа.
Состав и структура молекулы миозина
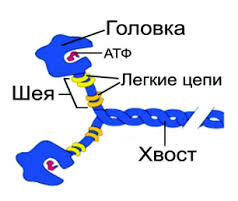
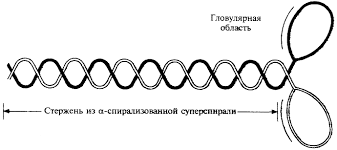
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). «Хвост» и «головки» сформированы из тяжелых цепей миозина. Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
На верхнем конце стержня две нити (тяжелые цепи миозина) расходятся, сплетаются с дополнительными двумя легкими цепями и формируют две миозиновые головки, основой которых также являются тяжелые цепи миозина. За счет головок длина миозиновой молекулы достигает 150 нм , а толщина – 2 нм. По этим характеристикам молекула миозина превосходит все молекулярные структуры, имеющиеся в природе.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2). Долгое время (середина XX века и начало XXI века на основе степени активности фермента АТФ-азы производилась классификация мышечных волокон на типы.

С конца ХХ века и по настоящее время на основе анализа тяжелых цепей миозина (МНС) производится разделение мышечных волокон на типы: MHCI, MHCIIa, MHCIIx.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
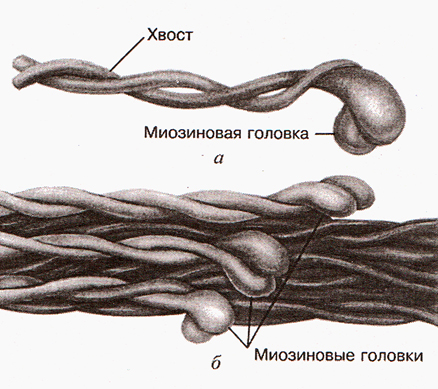

Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.
Литература
- Бендолл Дж. мышцы, молекулы и движение.- М.: Мир, 1970.- 256 с.
- Самойлов В.О., Бигдай Е.В. Клеточные и молекулярные основы биомеханики / В кн.: Математические модели и компьютерное моделирование в биомеханике: Учебное пособие.- СПб: Из-во Политехнического ун-та, 2004.- С. 29-102.
С уважением, А.В. Самсонова