Быстрый и медленный миозины как маркеры повреждения мышц
Установлено, что быстрый и медленный миозин могут выступать как маркеры повреждения мышц. Оценка уровня быстрого и медленного миозинов в крови через двое суток после травмы позволяет обнаружить повреждения I степени, так как быстрый миозин – исключительный маркер повреждения скелетной мышцы. Правильный диагноз позволяет предотвратить прогрессию повреждений у атлетов и помочь спортивным врачам в принятии решения.
Guerrero, M. Fast and slow myosins as markers of muscle injury / M. Guerrero, M. Guiu-Comadevall, J. A. Cadefau, J. Parra, R. Balius, A. Estruch, G. Rodas, J. L. Bedini, R. Cussó // British Journal of Sports Medicine.– 2008 July, 42.– V.7.- P.581-584
Гуэрреро М.
БЫСТРЫЙ И МЕДЛЕННЫЙ МИОЗИНЫ КАК МАРКЕРЫ ПОВРЕЖДЕНИЯ МЫШЦ
ABSTRACT
Цель: диагноз мышечных повреждений, перенесенных атлетами обычно делается в соответствии с клиническими критериями, объединенными с отображением повреждения (УЗИ (ультразвук) и/или МРТ), а также на основе анализов крови с целью обнаружить присутствие неспецифических маркеров повреждения мышцы. Это исследование было предпринято, чтобы оценить повреждение быстрых и медленных мышечных волокон, используя специфические маркеры повреждения этих волокон.
Методы: Образцы крови были получены от мужчин (n=51) не занимающих спортом и 38 спортсменов с повреждением скелетных мышц. Исследование крови (Western blood analysis) было выполнено, c целью определить быстрый и медленный миозины и уровень креатинкиназы. Повреждение скелетной мышцы было диагностировано физической экспертизой, УЗИ и МРТ, а также посредством биохимических маркеров.
Результаты: оптические тесты превосходны для того, чтобы обнаружить и подтвердить повреждение II и III степени. Однако, повреждения I степени этими методами не подтверждаются. Повреждения I степени характеризуются наличием в крови высокого уровнем быстрого миозина, немного меньшим медленного миозина и очень небольшим увеличением уровня креатинкиназы. Повреждения II и III степени характеризуются высоким уровнем как быстрого, так и медленного миозинов.
Заключение: оценка уровня быстрого и медленного миозинов в крови через 48 часов после повреждения позволяет обнаружить повреждения I степени, так как быстрый миозин – исключительный маркер скелетной мышцы. Правильный диагноз повреждения I степени может предотвратить прогрессию повреждений у атлетов, подвергающихся непрерывным тренировочным нагрузкам и соревнованиям, таким образом помогая спортивным врачам в принятии решения.
ВВЕДЕНИЕ
Мышца чувствительна к тренировочным протоколам, так как ее структура рассчитана на то, чтобы соответствовать им и адаптироваться к новым силовым нагрузкам. Однако, если целостность мышцы нарушена перегрузкой в большей или меньшей степени, происходит повреждение мышцы. Эти повреждения могут привести к неспособности к продолжению развития силы.
Использование непривычных упражнений и развитие высокого уровня силы при эксцентрических упражнениях приводит к повреждению мышцы с изменениями в ее структуре и функции. Это вызывает повреждение мембран мышечного волокна,1,2, разрушение миофибрилл3 и саркоплазматического ретикулума4. Такое вызванное упражнением повреждение мышцы активизирует каскад реакций, которые приводят к активизированному метаболизму белка скелетной мышцы. Немедленно после упражнения активизируется протеаза калпаин. Калпаин начинает метаболическое разрушение миофибриллярных белков, освобождая их из структуры миофиламентов5. Хотя калпаин не производит деградации актина и миозина, она вносит свой вклад в их выход в кровь6. Это позволяет обнаружить эти белки в периферийной крови после расщепления, используя оценку специфических индикаторов типа тропонина I (TnI) и тяжелых цепочек миозина (MHC).7,8 Sorichter et al9 описали особенности идеального маркера повреждения мышечного волокна. Во-первых, этот маркер должен быть специфически мышечным маркером, позволяющим диагносцировать повреждение мышечных волокон. Ни один из маркеров, проанализированных этими авторами, не является специфическим для мышцы.
Обычно используемые маркеры включают: креатинкиназу, сердечно-жирную кислоту связывающую белок, миоглобин, TnI (Тропонин I) и α-актин10. Однако, в дополнение к тому, чтобы они не являются полностью специфичными для скелетной мышцы, эти маркеры достигают максимального уровня менее чем за 10 часов после повреждения и существенно уменьшаются в течение 24 часов. Большинство повреждений происходит в течение выходных дней, и проходит более 10-12 критических часов, прежде чем пациент исследован. Новые повреждения часто не сопровождаются болью, но день спустя маркеры с низкой молекулярной массой деградируют не оставляя следа в сыворотке крови. Тропонины – белки, которые являются очень специфическими маркерами повреждения мышечных волокон; они имеют низкую молекулярную массу, но восприимчивы к протеолизу, что объясняет их очень короткое время полураспада в крови11.
Скелетная мышца – гетерогенная ткань, составленная из волокон I и II типов, соотношение которых зависит от типа мышцы и даже от области мышцы, в которой определялось это соотношение12. Некоторые из сократительных белков имеют различные изоформы в зависимости от типа волокна. Один из них – миозин, который имеет тяжелую и легкую изоформы, в зависимости от того, быстрый ли тип волокна или медленный13.
Миозин представляет собой идеальный маркер степени повреждения, из-за его высокой молекулярной массы. Его присутствие в крови можно объяснить только повреждением мышечного волокна. Быстрый миозин характерен только для быстрых скелетных мышц, в то время как медленный миозин характеризует как скелетную, так и сердечную мышцу. Уровень медленного миозина в крови был измерен Schiaffino и Reggiani14 и достигает максимальных значений через 48 и 72 часа после повреждения.
Цель этого исследования состоит в том, чтобы оценить повреждение мышцы, используя в качестве маркеров быстрый и медленный миозины в сыворотке крови атлетов через 48 часов после повреждения. Сравнить эффективность этих маркеров по обнаружению повреждения с УЗИ и МРТ, а также биохимическими методами.
МЕТОДЫ
Материалы
Материалы, используемые в исследовании были: моноклональный антимиозин (быстрый, скелетный) клон Мy-32 (Sigma, Мадрид, Испания), моноклональный антимиозин (медленный, скелетный) клон NOQ7.5.4D (Sigma), агароза (Sigma), белок A (Sigma) и loading buffer Nupage LDS типовой буфер (Novex, Калифорния, США).
Исследуемые
Были изучены тридцать шесть спортсменов в возрасте 18-25 лет (атлеты, жокеи, теннисисты, футболисты, баскетболисты и спортсмены, занимающиеся пятиборьем), которые испытывали боли в мышцах и/или их повреждение. Группа контроля включала 51 мужчину не занимающихся спортом в возрасте 18-55 лет.
Повреждения мышцы были классифицированы по трем категориям согласно клиническим полученным данным: повреждения I степени (DOMS, растяжение, небольшой разрыв мышцы); повреждение II степени (повреждение мышечных волокон, средний разрыв мышцы); повреждение III степени (разрушение мышечного волокна, видимый разрыв мышцы). Два мл крови были получены от 51 исследуемого контрольной группы и от атлетов через 48 часов после того, как они почувствовали проблемы с мышцами. Сыворотка крови использовалась для измерения уровней миозина.
Обработка образца
Образцы крови были получены в трубе Vacutainer и центрифугировались в 2000g в 4°C около 10 мин. Сыворотка сохранялась при температуре –80°C без потери миозина в течение 15 дней. Белок сыворотки крови определялся Брэдфордским методом15. Миозин присутствует как маркер в крови при очень низкой концентрации по сравнению с другими белками сыворотки.
Измерение ферментативных действий
Уровень креатинкиназы оценивался посредством Technicon DAX System автоанализатора согласно методу Szasz et al17.
Отображение повреждения
Эхография (УЗИ) выполнялась в Центре d’Estudis d’Alt Rendiment Esportiu (CEARE) и в ультразвуковом отделе Клиники FIATC. Использовалось оборудование Toshiba Medical System Системы с многочастотным исследованием (Just-Vision в CEARE, PowerVision в FIATC). МРТ исследования были проведены в отделе МРТ Клиники Corachan, используя устройство Siemens SYMPHONY (1.5 ТESS).
Оба типа сканирования дали результаты, которые увеличились в прямой пропорции со степенью повреждения. При повреждениях I степени УЗИ обычно показывает повреждение (гемоокрашивание и дефект некоторых волокон) спустя 2-3 дня после несчастного случая, в то время как МРТ показывает мышечный отек со времени повреждения. При повреждениях II степени и УЗИ и МРТ показывают отек и повреждение волокон. При повреждениях III степени виден большой отек и дефект, связанный с гематомой мышцы. И УЗИ и МРТ показывают развитие повреждения, наблюдая, как исчезает отек и осуществляется ремонт мышечных волокон.
Статистический анализ
Сравнивались уровни каждого маркера в контрольной группе и среди спортсменов с различным уровнем повреждения посредством дисперсионного анализом (ANOVA); оценки уровня значимости p <0,05 считались существенными.
РЕЗУЛЬТАТЫ
МРТ
Рис.1 показывает МРТ-изображения трех различных видов повреждения мышцы. Рис.1А – осевое представление повреждения I степени в верхней части правого бедра, показывая зону отека мышцы (сигнал увеличен), который вызван недавним надрывом двуглавой мышцы бедра (стрелки).
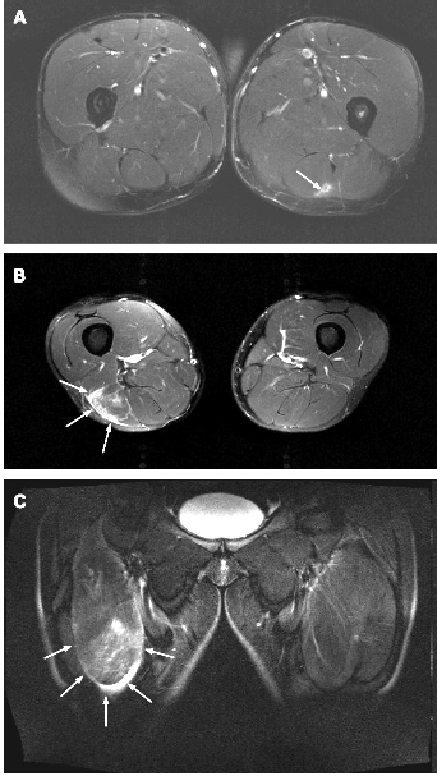
Рис.1В осевое представление повреждений II степени в медиально-дистальной части левого бедра показывая область отека (увеличение сигнала) и дефект мышечных волокон, вызванный недавним повреждением в длинной голове двуглавой мышце бедра (стрелки). В корональном представлении повреждения III степени дистальной части бедра, показанного на рис. 1С, большая область отека (увеличение сигнала) и обширный дефект мышечных волокон прямой мышцы бедра могут быть замечены в отдалённой от центра части (стрелки).
Ультразвуковые изображения
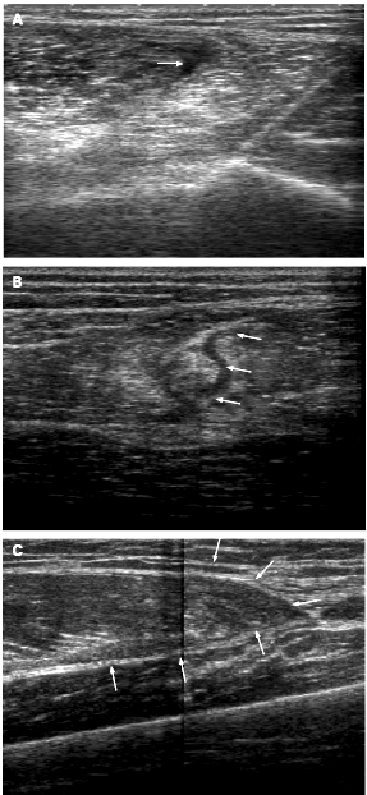
Рис. 2 показывает ультразвуковое изображение повреждений, изображенных на рис.1. Рис. 2A – продольный разрез области повреждения I степени, показывая, что область дефектов мышечных волокон находится между двуглавой мышцей бедра и полусухожильной мышцей. Продольный разрез области повреждений II степени, показанных на рис 2В указывает на самую обширную область дефектов мышечных волокон и гемоокрашивание в длинной головке двуглавой мышцы бедра. Ультразвуковое появление повреждений III степени, рис. 2С показывает полный дефект прямой мышцы бедра (стрелки).
Клинический диагноз, маркерные ферменты и миозин в нормальных и травмированных мышцах
Таблица 1 показывает нормальный уровень сыворотки крови у группы контроля и у атлетов с различной степенью повреждений мышцы.
Наши результаты указывают, что, в нормальном состоянии, концентрация быстрого и медленного миозинов в крови не превышала 1000 мг/мл – быстрого миозина и 2000 мг/мл – медленного миозина, показывая отношение быстрого миозина к медленному как 0,3. У пациентов с диагнозом повреждений I степени, которые не отображались на МРТ и УЗИ изображениях были отмечены высокие уровни быстрого миозина (больше чем медленного миозина), показывая отношение быстрого миозина к медленному > 2. Уровень креатинкиназы (КК) был почти нормальным. При повреждениях II и III степени, которые были диагностированы посредством УЗИ и МРТ уровень и быстрого и медленного миозинов возрос, так что отношение концентрации быстрого миозина к медленному было близко к 1,0. Концентрация медленного миозина по сравнению с быстрым миозином увеличилась в прямой пропорции к степени повреждения. Уровень КК также увеличился в том же самом направлении с возрастанием серьезности повреждений, что говорит о том, что он – очень хороший маркер для оценки повреждений II и III степени. Таблица 1
Диагноз | N | ультразвук (УЗИ) | МРТ | Креатинкиназа, u/л | Быстрый миозин, мг/л | Медленный миозин, мг/л | Отношение быстрого миозина к медленному |
норма | 51 | – | – | 102(8) | 625(62) | 1535(166) | 0,3 |
повреждение I степени | 12 | (-)0(-) | – | 202(22) | 2880(159) | 1281(197) | 2,2 |
повреждение II степени | 16 | ++ | ++ | 482(47) | 3432(402) | 3722(700) | 0,9 |
повреждение III степени | 10 | +++ | +++ | 739(245) | 8055(2200) | 6518(124) | 1,2 |
Примечание: представлены средние значения (ошибка среднего), Дисперсионный анализ свидетельствует о достоверных различиях между всеми параметрами.
ЗАКЛЮЧЕНИЕ
Человеческие мышцы представляют собой смесь медленных и быстрых волокон приблизительно с 50 % каждого типа. Этим они отличаются от животных, некоторые мышцы которых содержат 90 % быстрых волокон и приблизительно до 90 % медленных волокон. Широкая латеральная мышца молодых Кавказских атлетов в возрасте 15-18 лет имеет 36,5 % волокон медленного типа и 63,5 % волокон быстрого типа, из них 52,3 % — тип IIa, 8,1 % – тип IIb и 3,1 % – тип IIc18. Существование смешанных мышц у людей означает, что при их повреждениях в кровь поступают быстрый и медленный миозины. Однако, вследствие того, что сопротивление к повреждениям и утомлению этих двух типов волокон неодинаково, уровень медленного или быстрого миозина в крови зависит от типа поврежденного волокна. Вообще, быстрые волокна более легко повреждаются и более чувствительны к повреждению. Мы можем, поэтому ожидать, что быстрые волокна теряют свои быстрые MHC раньше, чем медленные волокна при менее интенсивном упражнении. Медленные MHC выходят в кровь при более утомительных упражнениях, и их присутствие в крови, вероятно указывает на более существенное повреждение.
С другой стороны, присутствие быстрых MHC в крови свидетельствует о том, что повреждена только скелетная мышца и таким образом представляет абсолютно специфический маркер. Присутствие медленных MHC может указывать на повреждения скелетной и/или сердечной мышцы. Однако, учитывая тот факт, что исследуемые были атлетами, у которых исключено сердечное повреждение, обнаружение медленных MHC в крови являлось бы маркером повреждения медленных волокон.
Мы развили метод, для обнаружения в крови миозинов, основанного на определении быстрых и медленных антител миозина. Мы изучили группу атлетов, участвующих в различных спортивных соревнованиях, которые ощущали боль в мышцах. Пациенты подверглись медицинской экспертизе, УЗИ и МРТ. У них брались анализы крови, которые включали измерение уровня креатинкиназы (используемый как обычный маркер повреждения мышцы), а также уровней быстрого и медленного миозина. Мы также изучили 51 человека, которые не занимались спортом, составивших контрольную группу. Наши результаты указывают, что, через 48 часов после возникновения проблем в мышце, уровень креатинкиназы незначительно возрастает при повреждениях I степени. Только быстрый миозин достигает высокого уровня, что позволяет предположить, что повреждения I степени происходят в волокнах II типа. Результаты УЗИ и МРТ при повреждениях I степени в некоторых случаях являются неявными, с отрицательными или положительными результатами, которые не в состоянии удостоверить полное признание повреждения. УЗИ и МРТ при повреждениях II и III степени были очень эффективны в обнаружении повреждений.
При повреждениях II степени измерение маркеров сыворотки крови показало увеличение уровня креатинкиназы а также увеличение уровней обоих типов миозина, достигая в некоторых случаях десятикратного увеличения по сравнению с нормой. Повреждения III степени хорошо детектируются креатинкиназой и обоими типами миозина.
Мы заключаем, что быстрый миозин является очень чувствительным маркером повреждений I степени. Степень диагносцирования посредством быстрого миозина находится на уровне МРТ и превосходит УЗИ и клинический диагноз. Быстрый миозин – специфичный маркер повреждения скелетной мышцы, уровень которого не могут достичь маркеры, используемые в настоящее время, типа креатинкиназы и миоглобина. Миозин также имеет преимущество из того, что он более чувствительный и более устойчивый в крови. Так как его максимальный уровень достигается чрез 48 часов после повреждения, и он дольше остается в крови, поэтому может легче применяться при запаздывающем диагностировании, а также может использоваться, чтобы следить за развитием повреждения мышцы. Мы поэтому заключаем, что определение быстрых и медленных миозинов — полезная помощь в диагнозе повреждений мышцы, особенно в тех случаях, которые трудно обнаружить другими методами.
Одобрение этики: Это исследование было одобрено комитетом этики Университета Барселоны и комитета этики Клиники Больницы Провинции Барселоны.
ЛИТЕРАТУРА
- Armstrong RB, Ogilvi RW, Schwane JA. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol 1983; 436: 735–41.
- Newman DJ, Jones DA, Ghosh G, et al. Muscle fatigue and pain after eccentric contractions at long and short length. Clin Sci 1988; 74: 553–7.[Medline]
- Friden J, Lieber RL. Structural and mechanical bases of exercise-induced muscle injury. Med Sci Sports Exerc 1992; 24: 521–30.[Medline]
- Frias JA, Cadefau JA, Prats C, et al. Disturbances of the sarcoplasmic reticulum and transverse tubular system in 24-h electrostimulated skeletal muscle. Biochem Biophys Acta 2005; 1668: 64–74.[Medline]
- Belcastro AN, Gilchrist JS, Scrubb JA, et al. Calcium-supported calpain degradation rates for cardiac myfibrils in diabetes. Sulfhydryl and hydrophobic interactions. Mol Cell Biochem 1994; 15: 51–60.
- Goll DE, Thompson VH, Taylor RG, et al. Is calpain activity regulated by membranes and autolysis or by calcium and calpastatin? BioEssays 1992; 14: 549–56.[CrossRef][Medline]
- Sorichter S, Mair J, Koller A, et al. Skeletal troponin I as a marker of exercise-induced muscle damage. J Appl Physiol 1997; 83: 1076–82.[Abstract/Free Full Text]
- Sorichter S, Mair J, Koller A, et al. Skeletal muscle troponin I release and magnetic resonance imaging signal intensity changes after eccentric exercise-induced skeletal muscle injury. Clin Chim Acta 1997; 262: 139–46.[CrossRef][Medline]
- Sorichter S, Puschendorf B, Mair J. Skeletal muscle injury induced by eccentric muscle action: muscle proteins as markers of muscle fiber injury. Exerc Immunol Rev 1999; 5: 5–21.[Medline]
- Martinez A, Marchal JA, Rodriguez F, et al. Role of
 -actin in muscle damage of injured athletes in comparison with traditional markers. Br J Sports Med 2007; 41: 442–6.[Abstract/Free Full Text]
-actin in muscle damage of injured athletes in comparison with traditional markers. Br J Sports Med 2007; 41: 442–6.[Abstract/Free Full Text] - Ebbeling CB, Clarkson PM. Exercise-induced muscle damage and adaptation. Sports Med 1989; 7: 207–34.[Medline]
- Lexell J, Henrikson-Larsen K, Sjostrom M. Distribution of different fibre types in human skeletal muscles. 2. A study of cross-sections of whole m. vastus lateralis. Acta Physiol Scand 1983; 117: 115–22.[Medline]
- Pette D, Staron RS. Myosin isoforms, muscle fiber types, and transitions. Microsc Res Tech 2000; 50: 500–9.[CrossRef][Medline]
- Schiaffino S, Reggiani C. Molecular diversity of miofibrillar proteins: gene regulation and funtional significance. Physiol Rev 1996; 76: 371–423.[Abstract/Free Full Text]
- Bradford MM. A rapid and sensitive method for the quantification of microgram quantities of protein utilising the principle of protein-dye binding. Anal Biochem 1976; 72: 248–54.[CrossRef][Medline]
- Hasten DL, Morris GS, Ramanadham S, et al. Isolation of human skeletal muscle myosin heavy chain and actin for measurement of fractional synthesis rates. Am J Physiol Endocrinol Metab 1998; 275: E1092–9.[Abstract/Free Full Text]
- Szasz G, Gruber W, Bernt E. Creatine kinase in serum. Determination of optimun reaction conditions. Clin Chem 1976; 22: 650–6.[Abstract/Free Full Text]
- Cadefau JA, Casademont J, Grau JM, et al. Biochemical and histochemical adaptation to sprint training in young athletes. Acta Physiol Scand 1990; 140: 341–51.[Medline]
Перевод выполнен А.В. Самсоновой
2008_M_-Guerrero_-et_-al_Перевод.pdf